Thi thử THPT môn Hoá Học online – Đề thi chính thức năm 2023 giúp bạn đánh giá chính xác mức độ hiểu bài thông qua nội dung bám sát chương trình học. Các câu hỏi được thiết kế khoa học giúp bạn học mà không cảm thấy áp lực. Đặc biệt phù hợp với học sinh muốn cải thiện điểm số. Thông qua quá trình làm bài, bạn có thể xác định phần kiến thức còn yếu. Điều này giúp việc học trở nên có mục tiêu rõ ràng hơn.
Thi thử THPT môn Hoá Học online – Đề thi chính thức năm 2023
Câu 1: Công thức của metyl axetat là
Câu 2: Axit axetic có công thức là
Câu 3: Dung dịch chất nào sau đây làm quỳ tím chuyến sang màu đỏ?
Câu 4: Chất nào sau đây làm mềm được nước có tính cứng vĩnh cửu?
Câu 5: $NaHCO_3$ được dùng làm bột nở, thuốc giảm đau dạ dày do thừa axit. Tên của $NaHCO_3$ là
Câu 6: Mặt trái của “hiệu ứng nhà kính” là gây ra sự khác thường về khí hậu, gây hạn hán, lũ lụt, ảnh hưởng đến môi trường sinh thái và cuộc sống con người. Khí chủ yếu gây ra hiện tượng này là
Câu 7: Đốt cháy hoàn toàn bột sắt trong khí clo dư, thu được hợp chất trong đó sắt có số oxi hóa là
Câu 8: Ở điều kiện thường, kim loại nào sau đây tồn tại ở trạng thái lỏng?
Câu 9: Hợp chất $Cr(OH)_3$ có tên là
Câu 10: Trong cùng điều kiện, ion kim loại nào sau đây có tính oxi hóa mạnh nhất?
Câu 11: $Al(OH)3$ tác dụng với dung dịch chất nào sau đây sinh ra $AlCl_3$?
Câu 12: Chất nào sau đây thuộc loại tripeptit?
Câu 13: Số nguyên tử cacbon trong phân tử saccarozo là
Câu 14: Kim loại Fe được điều chế trực tiếp từ $Fe_2O_3$ bằng phương pháp
Câu 15: Thạch cao nung được dùng để nặn tượng, đúc khuôn và bó bột khi gãy xương. Công thức của thạch cao nung là
Câu 16: Hợp chất $C_2H_5NHC_2H_5$ có tên là
Câu 17: Thủy phân hoàn toàn triglixerit X trong dung dịch NaOH thu được $C_{17}H_{35}COONa$ và $C_3H_5(OH)_3$. Công thức của X là
Câu 18: Poli(vinyl clorua) được điều chế trực tiếp từ monome nào sau đây?
Câu 19: Nhỏ dung dịch $NH_3$ đến dư vào dung dịch chất nào sau đây thu được kết tủa keo, màu trắng?
Câu 20: Khí tạo thành khi cho Mg tác dụng với dung dịch $H_2SO_4$ loãng là
Câu 21: Cho $Fe_2O_3$ vào dung dịch $H_2SO_4$ (loãng, dư) thu được dung dịch X. Thêm tiếp NaOH dư vào X , thu được kết tủa Y. Công thức của Y là
Câu 22: Đốt cháy hoàn toan 13,2 gam este X, thu được 0,6 mol $CO_2$ và 0,6 mol $H_2O$ . Công thức phân tử của X là
Câu 23: Phát biểu nào sau đây sai?
Câu 24: Cho các polime sau: polibutađien, poli(metyl metacrylat), poliacrilonitrin, nilon-6,6. Số polime được điều chế bằng phản ứng trùng ngưng là
Câu 25: Thực hiện phản ứng este hóa giữa HOCC - COOH với hỗn hợp $CH_3OH$ và $C_2H_5OH$ thu được tối đa bao nhiêu este hai chức?
Câu 26: Cho m gam bột Fe tác dụng hoàn toàn với dung dịch $CuSO_4$ dư, thu được 9,6 gam kim loại Cu. Giá trị của m là
Câu 27: Từ mkg mùn cưa chứa 50% xenlulozơ (còn lại là tạp chất trơ) sản xuất được 80kg glucozo với hiệu suất toàn bộ quá trình là 80%. Giá trị của m là
Câu 28: Khối lượng metylamin cần để tác dụng vừa đủ với 0.01 mol HCl là
Câu 29: Phát biểu nào sau đây đúng?
Câu 30: Oxi hóa hoàn toàn 11,5 gam hỗn hợp X (gồm Mg, Al và Zn ) bằng $O_2$, thu được 17,1 gam hỗn hợp Y gồm các oxit. Để hòa tan hết Y cần vừa đủ V ml dung dịch HCl 2M. Giá trị của V là
Câu 31: Cho các phát biểu sau: (a) Ala-Gly có phản ứng màu biure. (b) Amino axit là loại hợp chất hữu cơ tạp chức. (c) Axit 6-aminohexanoic là nguyên liệu để sản xuất tơ nilon-6. (d) Thực hiện phản ứng trùng ngưng các amino axit đều thu được peptit. (đ) Thành phần của bột ngọt (mì chính) chỉ chứa các nguyên tố C, H, Na và O. Số phát biểu đúng là
Câu 32: Thực hiện thí nghiệm theo các bước sau: Bước 1: Cho một định sắt đã cạo sạch gỉ vào ống nghiệm. Bước 2: Thêm tiếp vào ống nghiệm 4 - 5ml dung dịch $H_2SO_4$ loãng. Bước 3: Lấy đinh sắt ra rồi nhỏ dần từng giọt dung dịch $K_2Cr_2O_7$ trong $H_2SO_4$ loãng vào ống nghiệm và lắc đều. Cho các phát biểu sau: (a) Trong bước 2 , không xuất hiện bọt khí. (b) Trong bước 2 , kim loại sắt bị khử thành hợp chất sắt (III). (c) Trong bước 3 , hợp chất sắt (II) bị oxi hóa thành hợp chất sắt (III). (d) Trong bước 3 , hợp chất crom (VI) bị khử thành hợp chất crom (III). (đ) Ở bước 2 , nếu thay dung dịch $H_2SO_4$ loãng bằng dung dịch HCl thì có xuất hiện bọt khí. Số phát biểu đúng là
Câu 33: Cho 19,5 gam hỗn hợp Al và kim loại M tác dụng với dung dịch $HNO_3$ dư, thu được dung dịch X (không chứa muối amoni) và 0.6 mol hỗn hợp B (gồm NO và $NO_2$ ) có tỉ khối so với $H_2$ bằng 19 . Cô cạn X thu được m gam hỗn hợp muối Y. Nung Y đến khối lượng không đổi thu được chất rắn Z và hỗn hợp E gồm khí và hơi. Cho toàn bộ E vào 300 gram nước, không có khí thoát ra và dung dịch thu được chỉ chứa một chất tan, có nồng độ 17,598%. Giá trị của m gần nhất với giá trị nào sau đây?
Câu 34: Cho hơi nước đi qua than nung đỏ, thu được 0,735 mol hỗn hợp khí X (gồm CO, $CO_2$ và $H_2$). Cho toàn bộ X tác dụng hết với CuO (dư, nung nóng) thu được hỗn hợp chất rắn Y. Hòa tan hoàn toàn Y bằng dung dịch $H_2SO_4$ (đặc, nóng, dư) thu được 0.57 mol $SO_2$ (sản phẩm khử duy nhất). Phần trăm thể tích của khí CO trong X là
Câu 35: Hỗn hợp E gồm hai hiđrocacbon mạch hở X,Y với $M_x < M_y < 80$. Cho 0,1 mol E, có khối lượng 4,7 gam, vào lượng dư dung dịch $AgNO_3$ trong $NH_3$ thu được 22,89 gam hỗn hợp kết tủa. Biết các phản ứng đều xảy ra hoàn toàn. Phần trăm khối lượng của Y trong E là
Câu 36: Phân tích nguyên tố hợp chất hữu cơ mạch hở E cho kết quả phần trăm khối lượng cacbon, hiđro, oxi lần lượt là 40,68%; 5,08%; 54,24% . Phương pháp phân tích phổ khối lượng (phổ MS) cho biết E có phân tử khối bằng 118 . Từ E thực hiện sơ đồ các phản ứng sau theo đúng tỉ lệ mol: (1) (2) (3) Biết: Z là ancol đơn chức; F và T là các hợp chất hữu cơ; $M_f < M_t$ Phát biểu nào sau đây sai?
Câu 37: Hỗn hợp E gồm ba este mạch hở X, Y, Z (chỉ chứa chức este) đều tạo bởi axit cacboxylic với ancol no, trong đó: X đơn chức, Y hai chức, Z ba chức. Đốt cháy m gam E trong $O_2$ dư, thu được 0,44 mol $CO_2$ và 0.352 mol $H_2O$. Mặt khác, cho m gam E phản ứng vừa đủ với dung dịch NaOH, thu được hỗn hợp F gồm các ancol và 12,224 gam hỗn hợp muối khan T . Đốt cháy toàn bộ T thu được $Na_2CO_3$, 0,212 mol $CO2$ và 0,204 mol $H_2O$. Biết các phản ứng đều xảy ra hoàn toàn, các muối trong T đều không có khả năng tham gia phản ứng tráng bạc. Phần trăm khối lượng của Z trong E là
Câu 38: Cho các phát biểu sau: (a) Hỗn hợp tecmit được dùng để hàn đường ray. (b) Bột nhôm tự bốc cháy khi tiếp xúc với khí clo. (c) Nhôm là nguyên tố phổ biến nhất trong vỏ Trái Đất. (d) Kim loại Al có màu trắng bạc, nhẹ, dẫn điện và dẫn nhiệt tốt. (đ) Trong công nghiệp, quặng boxit được dùng làm nguyên liệu để sản xuất nhôm. Số phát biểu đúng là
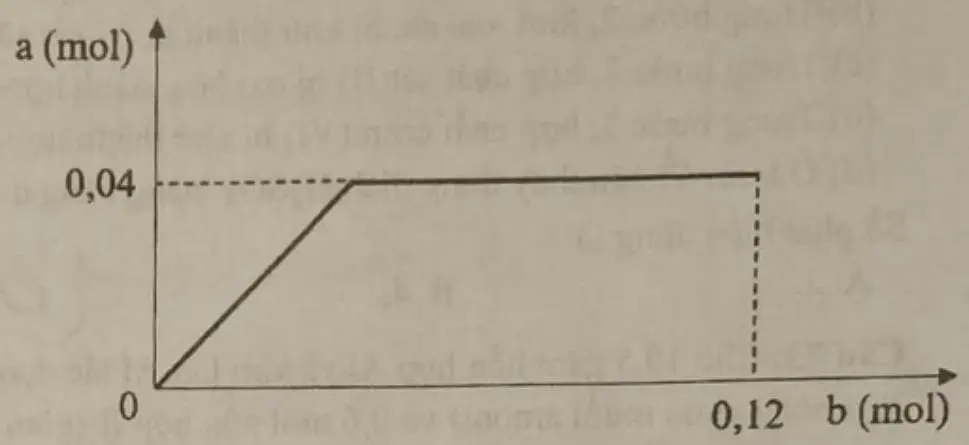
Câu 39: Cho m gam hỗn hợp X (gồm Na, $Na_2O$, Ba và BaO) vào $H2O$ dư, thu được dung dịch Y và 0,06 mol $H_2$. Sục từ từ đến hết 0,12 mol $CO_2$ vào Y, thu được dung dịch Z và kết tủa $BaCO_3$. Sự phụ thuộc của số mol kết tủa $BaCO_3$( a mol) vào số ml $CO_2$ (b mol) được biểu diễn theo đồ thị bên. Cho từ từ đến hết Z vào 30ml dung dịch HCl 11M, thu được 0,02 mol $CO_2$. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của m là
Câu 40: Poli(etylen terephtalat) (viết tắt là PET) là một polime được điều chế từ axit terephtalic và etylen glicol. PET được sử dụng để sản xuất tơ, chai đựng nước uống, hộp đựng thực phẩm. Để thuận lợi cho việc nhận biết, sử dụng và tái chế thì các đồ nhựa làm từ vật liệu chứa PET thường được in kí hiệu như hình bên. Cho các phát biểu sau: (a) PET thuộc loại polieste. (b) Tơ được chế tạo từ PET thuộc loại tơ tổng hợp. (c) Trong một mắt xích PET, phần trăm khối lượng cacbon là 62,5% (d) Phản ứng tổng hợp PET từ axit terephtalic và etylen glicol thuộc loại phản ứng trùng hợp. (đ) Trong dung dịch, etylen glicol phản ứng với $Cu(OH)_2$ tạo dung dịch màu xanh lam. Số phát biểu đúng là
