Thi thử trắc nghiệm online môn Hoá Học – Đề thi minh họa tốt nghiệp THPT năm 2022 của bộ GD&ĐT giúp bạn ôn tập kiến thức một cách có hệ thống thông qua hệ thống câu hỏi đa dạng. Các câu hỏi được sắp xếp từ dễ đến khó giúp bạn tiếp cận kiến thức từng bước. Đặc biệt phù hợp với những bạn đang ôn thi. Thông qua quá trình làm bài, bạn có thể nhận ra lỗ hổng kiến thức. Điều này giúp việc học trở nên chủ động hơn.
Thi thử trắc nghiệm online môn Hoá Học – Đề thi minh họa tốt nghiệp THPT năm 2022 của bộ GD&ĐT
Câu 1: Câu 1. Chất nào sau đây là chất điện li yếu?
Câu 2: Câu 2. Trong phân tử chất nào sau đây có 1 nhóm amino (NH2) và 2 nhóm cacboxyl (COOH)?
Câu 3: Câu 3. Kim loại nào sau đây thuộc nhóm IA trong bảng tuần hoàn?
Câu 4: Câu 4. Khi làm thí nghiệm với HNO3 đặc thường sinh ra khí NO2 có màu nâu đỏ, độc và gây ô nhiễm môi trường. Tên gọi của NO2 là
Câu 5: Câu 5. Polime nào sau đây có công thức(-CH2-CH(CN))n?
Câu 6: Câu 6. Kim loại Mg tác dụng với HCl trong dung dịch tạo ra H2 và chất nào sau đây?
Câu 7: Câu 7. Axit panmitic là một axit béo có trong mỡ động vật và dầu cọ. Công thức của axit panmitic là
Câu 8: Câu 8. Kim loại nào sau đây điều chế được bằng phương pháp thủy luyện?
Câu 9: Câu 9. Số oxi hóa của sắt trong hợp chất Fe2(SO4)3 là
Câu 10: Câu 10. Chất nào sau đây tác dụng với kim loại Na sinh ra khí H2?
Câu 11: Câu 11. X là kim loại cứng nhất, có thể cắt được thủy tinh. X là
Câu 12: Câu 12. Kim loại Fe tan hết trong lượng dư dung dịch nào sau đây?
Câu 13: Câu 13. Nhôm bền trong không khí và nước do trên bề mặt của nhôm được phủ kín lớp chất X rất mỏng, bền. Chất X là
Câu 14: Câu 14. Số nguyên tử hiđro trong phân tử metyl fomat là
Câu 15: Câu 15. Phân tử chất nào sau đây chứa nguyên tử nitơ?
Câu 16: Câu 16. Glucozơ là chất dinh dưỡng và được dùng làm thuốc tăng lực cho người già, trẻ em và người ốm. Số nguyên tử cacbon trong phân tử glucozơ là
Câu 17: Câu 17. Kim loại nào sau đây tan hoàn toàn trong nước dư?
Câu 18: Câu 18. Tính cứng tạm thời của nước do các muối canxi hiđrocacbonat và magie hiđrocacbonat gây nên. Công thức của canxi hiđrocacbonat là
Câu 19: Câu 19. Trong dung dịch, ion nào sau đây oxi hóa được kim loại Fe?
Câu 20: Câu 20. Phèn chua được dùng trong ngành thuộc da, công nghiệp giấy, làm trong nước,.. Công thức phèn chua là
Câu 21: Câu 21. Este X có công thức phân tử C4H8O2. Thủy phân X trong dung dịch NaOH dư, thu được sản phẩm gồm natri propionat và ancol Y. Công thức của Y là
Câu 22: Câu 22. Phát biểu nào sau đây đúng?
Câu 23: Câu 23. Nhiệt phân hoàn toàn m gam NaHCO3, thu được Na2CO3, H2O và 3,36 lít CO2. Giá trị của m là
Câu 24: Câu 24. Cho dung dịch chứa m gam glucozơ tác dụng với lượng dư AgNO3 trong dung dịch NH3, sau phản ứng hoàn toàn thu được 21,6 gam Ag. Giá trị của m là
Câu 25: Câu 25. Chất nào sau đây tác dụng với dung dịch HCl sinh ra muối FeCl3?
Câu 26: Câu 26. Cho các tơ sau: visco, xenlulozơ axetat, nilon-6, nilon-6,6. Số tơ nhân tạo là
Câu 27: Câu 27. Để khử hoàn toàn 16,0 gam Fe2O3 thành kim loại Fe ở nhiệt độ cao (không có oxi) cần tối thiểu m gam kim loại Al. Giá trị của m là
Câu 28: Câu 28. Đốt cháy hoàn toàn m gam glyxin trong O2 thu được N2, H2O và 6,72 lít CO2. Giá trị của m là
Câu 29: Câu 29. Hỗn hợp E gồm ba este no, mạch hở X (đơn chức), Y (hai chức), Z (ba chức) đều được tạo thành từ axit cacboxylic và ancol. Đốt cháy hoàn toàn m gam E, thu được số mol CO2 lớn hơn số mol H2O là 0,425 mol. Mặt khác, m gam E phản ứng vừa đủ với dung dịch NaOH, thu được hỗn hợp T gồm hai muối và 28,6 gam hai ancol. Đốt cháy hoàn toàn T cần vừa đủ 0,25 mol O2, thu được CO2, 0,35 mol Na2CO3 và 0,15 mol H2O. Khối lượng của X trong m gam E là
Câu 30: Câu 30. Đốt hỗn hợp X gồm Fe và Cu trong O2, thu được m gam hỗn hợp Y gồm Fe, Cu, Fe3O4 và CuO. Cho Y vào dung dịch chứa 0,2 mol HCl, thu được dung dịch Z chỉ chứa muối, 0,05 mol H2 và 9,2 gam chất rắn T. Cho T tác dụng với dung dịch HCl có khí thoát ra. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
Câu 31: Câu 31. Cho hai chất hữu cơ mạch hở E, F có cùng công thức đơn giản nhất là CH2O. Các chất E, F, X tham gia phản ứng theo đúng tỉ lệ mol như sơ đồ dưới đây: E + NaOH → X + Y F + NaOH→ X + Z X + HCl →T + NaCl Biết: X, Y, Z, T là các chất hữu cơ và ME < MF < 100. Cho các phát biểu sau: (a) Chất X có khả năng tham gia phản ứng tráng bạc. (b) Từ chất Y điều chế trực tiếp được axit axetic. (c) Oxi hóa Z bằng CuO, thu được anđehit axetic. (d) Chất F làm quỳ tím chuyển thành màu đỏ. (đ) Chất T có nhiệt độ sôi lớn hơn ancol etylic. Số phát biểu đúng là:
Câu 32: Câu 32. Hỗn hợp X gồm triglixerit Y và axit béo Z. Cho m gam X phản ứng hoàn toàn với dung dịch NaOH dư, thu được sản phẩm hữu cơ gồm hai muối có cùng số nguyên tử cacbon và 2,76 gam glixerol. Nếu đốt cháy hết m gam X thì cần vừa đủ 3,445 mol O2, thu được 2,43 mol CO2 và 2,29 mol H2O. Khối lượng của Y trong m gam X là
Câu 33: Câu 33. Cho m gam hỗn hợp X gồm FeS2, FeCO3, CuO và Fe2O3 (trong X nguyên tố oxi chiếm 15,2% về khối lượng) vào bình kín (thể tích không đổi) chứa 0,54 mol O2 (dư). Nung nóng bình đến khi các phản ứng xảy ra hoàn toàn rồi đưa về nhiệt độ ban đầu thì áp suất trong bình giảm 10% so với áp suất ban đầu (coi thể tích chất rắn thay đổi không đáng kể). Mặt khác, hòa tan hết m gam X bằng dung dịch H2SO4 đặc nóng, thu được dung dịch Y chứa 1,8m gam hỗn hợp muối (gồm Fe2(SO4)3, CuSO4) và 1,08 mol hỗn hợp khí gồm CO2, SO2. Giá trị của m là
Câu 34: Câu 34. Cho các phát biểu sau: (a) Phân đạm urê cung cấp cho cây trồng nguyên tố kali. (b) Điện phân dung dịch CuSO4 thu được kim loại Cu ở anot. (c) Sục khí CO2 tới dư vào dung dịch NaAlO2 có xuất hiện kết tủa. (d) Các đồ vật bằng sắt khó bị ăn mòn hơn sau khi được quét sơn lên bề mặt. Số phát biểu đúng là:
Câu 35: Câu 35. Cho sơ đồ chuyển hóa: Biết: X, Y, Z, E, F là các hợp chất khác nhau, mỗi mũi tên ứng với một phương trình hóa học của phản ứng xảy ra giữa hai chất tương ứng. Các chất E, F thỏa mãn sơ đồ trên lần lượt là
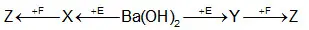
Câu 36: Câu 36. Nung nóng a mol hỗn hợp X gồm propen, axetilen và hiđro với xúc tác Ni trong bình kín (chỉ xảy ra phản ứng cộng H2), sau một thời gian thu được hỗn hợp khí Y có tỉ khối so với X là 1,25. Đốt cháy hết Y, thu được 0,87 mol CO2 và 1,05 mol H2O. Mặt khác, Y phản ứng tối đa với 0,42 mol brom trong dung dịch. Giá trị của a là
Câu 37: Câu 37. Nung m gam hỗn hợp X gồm Fe(NO3)2 và KNO3 (trong bình kín, không có không khí) đến khối lượng không đổi, thu được chất rắn Y và hỗn hợp khí Z. Hấp thụ hết Z vào nước, thu được 400 ml dung dịch E (chỉ chứa một chất tan) có pH = 1, không có khí thoát ra. Giá trị của m là
Câu 38: Câu 38. Điện phân (điện cực trơ, màng ngăn xốp) dung dịch gồm CuSO4 và NaCl (tỉ lệ mol tương ứng 1: 3) với cường độ dòng điện 2,68A. Sau thời gian t giờ, thu được dung dịch Y (chứa hai chất tan) có khối lượng giảm 20,75 gam so với dung dịch ban đầu. Cho bột Al dư vào Y, thu được 3,36 lít khí H2. Biết các phản ứng xảy ra hoàn toàn, hiệu suất điện phân 100%, bỏ qua sự bay hơi của nước. Giá trị của t là
Câu 39: Câu 39. Cho các phát biểu sau: (a) Tơ nitron thuộc loại tơ poliamit. (b) Mỡ động vật, dầu thực vật tan nhiều trong benzen. (c) Dung dịch lysin làm quỳ tím chuyển sang màu hồng. (d) Poli(metyl metacrylat) được dùng để chế tạo thuỷ tinh hữu cơ. (đ) Tinh bột được tạo thành trong cây xanh nhờ quá trình quang hợp. Số phát biểu đúng là
Câu 40: Câu 40. Tiến hành thí nghiệm theo các bước sau: Bước 1: Cho vào bát sứ nhỏ khoảng 1 gam dầu thực vật và 3 ml dung dịch NaOH 40%. Bước 2: Đun sôi nhẹ và khuấy liên tục hỗn hợp bằng đũa thủy tinh. Thỉnh thoảng nhỏ thêm vài giọt nước cất để giữ thể tích hỗn hợp phản ứng không đổi. Bước 3: Sau 8 – 10 phút, rót thêm vào hỗn hợp 4 – 5 ml dung dịch NaCl bão hòa nóng, khuấy nhẹ. Sau đó để yên hỗn hợp 5 phút, lọc tách riêng phần dung dịch và chất rắn. Phát biểu nào sau đây sai?