Thi thử trắc nghiệm online môn Hoá Học – Đề thi chính thức THPT quốc gia 2018 – Mã đề 201 giúp bạn nhận biết điểm mạnh và điểm yếu của bản thân thông qua dạng bài tập quen thuộc thường gặp trong đề thi. Các câu hỏi được xây dựng theo lộ trình giúp bạn tự tin hoàn thành bài quiz. Đặc biệt phù hợp với người học muốn tự đánh giá năng lực. Thông qua quá trình làm bài, bạn có thể điều chỉnh phương pháp học tập cho phù hợp. Điều này giúp việc học trở nên tiết kiệm thời gian hơn.
Thi thử trắc nghiệm online môn Hoá Học – Đề thi chính thức THPT quốc gia 2018 – Mã đề 201
Câu 1: Câu 1. Kim loại Fe KHÔNG phản ứng với dung dịch
Câu 2: Câu 2. Hợp chất nào sau đây có tính lưỡng tính?
Câu 3: Câu 3. Trùng hợp propilen thu được polime có tên gọi là
Câu 4: Câu 4. Chất nào sau đây tác dụng được với dung dịch $AgNO_3$ trong $NH_3$?
Câu 5: Câu 5. Kim loại nào sau đây có nhiệt độ nóng chảy thấp nhất?
Câu 6: Câu 6. Cho vài giọt quỳ tím vào dung dịch $NH_3$ thì dung dịch chuyển thành
Câu 7: Câu 7. Dung dịch chất nào sau đây có thể hòa tan được $CaCO_3$?
Câu 8: Câu 8. Kim loại nào sau đây phản ứng được với dung dịch NaOH?
Câu 9: Câu 9. Chất nào sau đây là muối axit?
Câu 10: Câu 10. Công thức phân tử của etanol là
Câu 11: Câu 11. Fructozơ là một loại monosaccarit có nhiều trong mật ong, có vị ngọt sắc. Công thức phân tử của fructozơ là
Câu 12: Câu 12. Một trong những nguyên nhân gây tử vong trong nhiều vụ cháy là do nhiễm độc khí X. Khi vào cơ thể, khí X kết hợp với hemoglobin, làm giảm khả năng vận chuyển oxi của máu. Khí X là
Câu 13: Câu 13. Thực hiện thí nghiệm như hình vẽ bên. Hiện tượng xảy ra trong bình chứa dung dịch $Br_2$ là
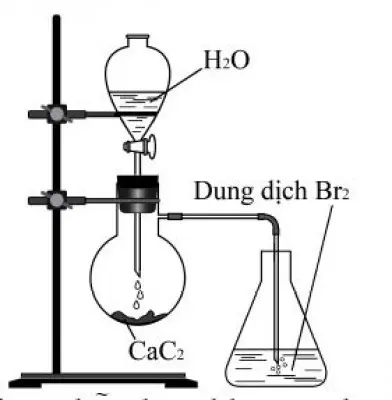
Câu 14: Câu 14. Dẫn khí CO dư qua ống sứ đựng 7,2 gam bột FeO nung nóng, thu được hỗn hợp khí X. Cho toàn bộ X vào nước vôi trong dư, thu được m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
Câu 15: Câu 15. Cho 15,6 gam hỗn hợp X gồm $Al$ và $Al_2O_3$ tác dụng với dung dịch $NaOH$ dư, thu được 6,72 lít khí $H_2$ ở đktc. Khối lượng của $Al_2O_3$ trong X là
Câu 16: Câu 16. Cặp chất nào sau đây cùng tồn tại trong một dung dịch?
Câu 17: Câu 17. Cho các dung dịch: $C_6H_5NH_2 (anilin), CH_3NH_2, H_2N-[CH_2]_4-CH(NH_2)-COOH$ và $H_2NCH_2COOH$. Số dung dịch làm đổi màu phenolphtalein là
Câu 18: Câu 18. Thủy phân este X trong dung dịch axit, thu được $CH_3COOH$ và $CH_3OH$. Công thức cấu tạo của X là
Câu 19: Câu 19. Cho 15 gam hỗn hợp gồm hai amin đơn chức tác dụng vừa đủ với V ml dung dịch HCl 0,75M, thu được dung dịch chứa 23,76 gam hỗn hợp muối. Giá trị của V là
Câu 20: Câu 20. Cho 0,9 gam glucozơ ($C_6H_12O6$) tác dụng hết với lượng dư dung dịch $AgNO3$ trong $NH_3$, thu được (m) gam $Ag$. Giá trị của m là
Câu 21: Câu 21. Nung m gam hỗn hợp X gồm $KHCO_3$ và $CaCO_3$ ở nhiệt độ cao đến khối lượng không đổi, thu được chất rắn Y. Cho Y vào nước dư, thu được 0,2m gam chất rắn Z và dung dịch E. Nhỏ từ từ dung dịch $HCl$ 1M vào E, khi khí bắt đầu thoát ra cần dùng $V_1$ lít dung dịch $HCl$ và đến khi khí thoát ra vừa hết thì thể tích dung dịch $HCl$ đã dùng là $V_2$ lít. Tỉ lệ $V_1 : V_2$ tương ứng là
Câu 22: Câu 22. Cho 11,2 lít (đktc) hỗn hợp X gồm $C_2H_2$ và $H_2$ qua bình đựng Ni (nung nóng), thu được hỗn hợp Y (chỉ chứa ba hiđrocacbon) có tỉ khối so với $H_2$ là 14,5. Biết Y phản ứng tối đa với a mol $Br_2$ trong dung dịch. Giá trị của a là
Câu 23: Câu 23. Cho các sơ đồ phản ứng theo đúng tỉ lệ mol: Cho biết: X là este có công thức phân tử $C_{10}H_{10}O_4; X_1, X_2, X_3, X_4, X_5, X_6$ là các hợp chất hữu cơ khác nhau. Phân tử khối của $X_6$ là
Câu 24: Câu 24. Cho từ từ đến dư dung dịch $Ba(OH)_2$ vào dung dịch chứa m gam hỗn hợp $Al_2(SO_4)_3$ và $AlCl_3$. Sự phụ thuộc của khối lượng kết tủa (y gam) vào số mol $Ba(OH)_2$ (x mol) được biểu diễn bằng đồ thị bên. Giá trị của m là
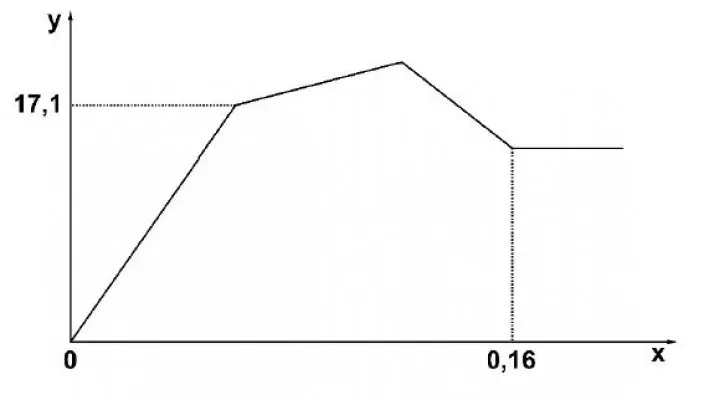
Câu 25: Câu 25. Cho các phát biểu sau: (a) Thủy phân triolein, thu được etylen glicol. (b) Tinh bột bị thủy phân khi có xúc tác axit hoặc enzim. (c) Thủy phân vinyl fomat, thu được hai sản phẩm đều có phản ứng tráng bạc. (d) Trùng ngưng axit ε-aminocaproic, thu được policaproamit. (e) Chỉ dùng quỳ tím có thể phân biệt ba dung dịch: alanin, lysin, axit glutamic. (g) Phenylamin tan ít trong nước nhưng tan tốt trong dung dịch HCl. Số phát biểu đúng là:
Câu 26: Câu 26. Cho các sơ đồ phản ứng sau: (a) $X (dư) + Ba(OH)_2 → Y + Z $ (b) $X + Ba(OH)_2 (dư) → Y + T + H_2O $ Biết các phản ứng đều xảy ra trong dung dịch và chất Y tác dụng được với dung dịch $H_2SO_4$ loãng. Hai chất nào sau đây đều thỏa mãn tính chất của X?
Câu 27: Câu 27. Cho các chất: $Cr, FeCO_3, Fe(NO_3)_2, Fe(OH)_3, Cr(OH)_3, Na_2CrO_4$. Số chất phản ứng được với dung dịch $HCl$ là
Câu 28: Câu 28. Thủy phân hoàn toàn triglixerit X trong dung dịch $NaOH$, thu được glixerol, natri stearat và natri oleat. Đốt cháy hoàn toàn m gam X cần vừa đủ 3,22 mol $O_2$, thu được $H_2O$ và 2,28 mol $CO_2$. Mặt khác, m gam X tác dụng tối đa với a mol $Br_2$ trong dung dịch. Giá trị của a là
Câu 29: Câu 29. Thực hiện các thí nghiệm sau: (a) Cho bột $Mg$ dư vào dung dịch $FeCl_3$. (b) Đốt dây $Fe$ trong khí $Cl_2$ dư. (c) Cho bột $Fe_3O_4$ vào dung dịch $H_2SO_4$ đặc, nóng, dư. (d) Cho bột Fe vào dung dịch $AgNO_3$ dư. (e) Cho bột Fe dư vào dung dịch $HNO_3$ loãng. (g) Cho bột FeO vào dung dịch $KHSO_4$. Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được muối sắt (II) là
Câu 30: Câu 30. Thủy phân hoàn toàn 1 mol peptit mạch hở X, thu được 2 mol Gly, 1 mol Ala và 1 mol Val. Mặt khác, thủy phân không hoàn toàn X, thu được hỗn hợp các amino axit và các peptit (trong đó có Ala-Gly và Gly-Val). Số công thức cấu tạo phù hợp với tính chất của X là
Câu 31: Câu 31. Kết quả thí nghiệm của các chất X, Y, Z với các thuốc thử được ghi ở bảng. Các chất X, Y, Z lần lượt là:
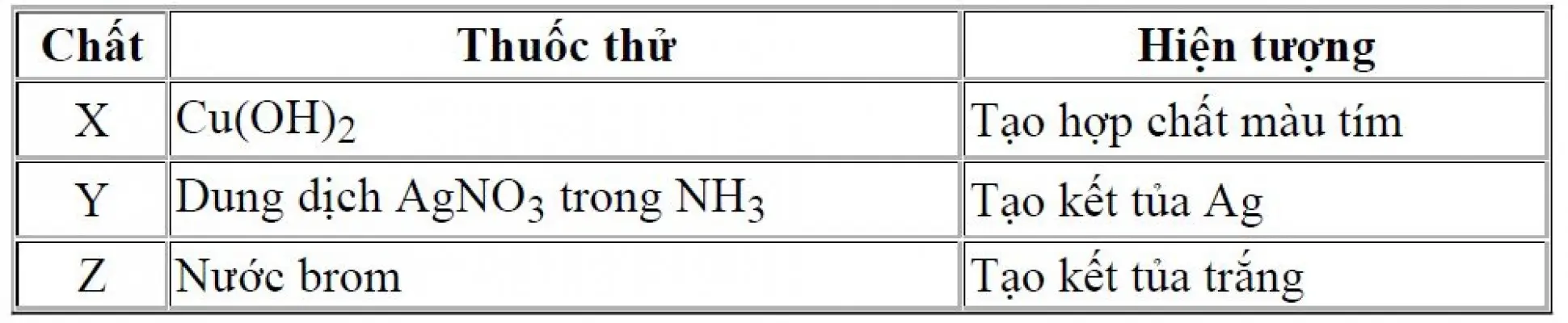
Câu 32: Câu 32. Cho các phát biểu sau: (a) Điện phân dung dịch $NaCl$ với điện cực trơ, thu được khí $H_2$ ở catot. (b) Dùng khí $CO$ (dư) khử $CuO$ nung nóng, thu được kim loại $Cu$. (c) Để hợp kim $Fe-Ni$ ngoài không khí ẩm thì kim loại Ni bị ăn mòn điện hóa học. (d) Dùng dung dịch $Fe_2(SO_4)_3$ dư có thể tách $Ag$ ra khỏi hỗn hợp $Ag$ và $Cu$. (e) Cho Fe dư vào dung dịch $AgNO_3$, sau phản ứng thu được dung dịch chứa hai muối. Số phát biểu đúng là
Câu 33: Câu 33. Hòa tan hết 28,16 gam hỗn hợp rắn X gồm $Mg, Fe_3O_4$ và $FeCO_3$ vào dung dịch chứa $H_2SO_4$ và $NaNO_3$, thu được 4,48 lít (đktc) hỗn hợp khí Y (gồm $CO_2, NO, N_2, H_2$) có khối lượng 5,14 gam và dung dịch Z chỉ chứa các muối trung hòa. Dung dịch Z phản ứng tối đa với 1,285 mol $NaOH$, thu được 43,34 gam kết tủa và 0,56 lít khí (đktc). Nếu cho Z tác dụng với dung dịch $BaCl_2$ dư thì thu được 166,595 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng Mg trong X là
Câu 34: Câu 34. Hỗn hợp E gồm bốn este đều có công thức $C_8H_8O_2$ và có vòng benzen. Cho m gam E tác dụng tối đa với 200 ml dung dịch $NaOH$ 1M (đun nóng), thu được hỗn hợp X gồm các ancol và 20,5 gam hỗn hợp muối. Cho toàn bộ X vào bình đựng kim loại $Na$ dư, sau khi phản ứng kết thúc khối lượng chất rắn trong bình tăng 6,9 gam so với ban đầu. Giá trị của m là
Câu 35: Câu 35. Điện phân dung dịch X gồm $Cu(NO3)2$ và NaCl với điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi $I = 2,5A$. Sau $t$ giây, thu được 7,68 gam kim loại ở catot, dung dịch Y (vẫn còn màu xanh) và hỗn hợp khí ở anot có tỉ khối so với $H_2$ bằng 25,75. Mặt khác, nếu điện phân X trong thời gian 12352 giây thì tổng số mol khí thu được ở hai điện cực là 0,11 mol. Giả thiết hiệu suất điện phân là 100%, các khí sinh ra không tan trong nước và nước không bay hơi trong quá trình điện phân. Số mol ion $Cu^{2^+}$ trong Y là
Câu 36: Câu 36. Thực hiện phản ứng nhiệt nhôm hỗn hợp gồm Al và m gam hai oxit sắt trong khí trơ, thu được hỗn hợp chất rắn X. Cho X vào dung dịch NaOH dư, thu được dung dịch Y, chất không tan Z và 0,672 lít khí H_2 (đktc). Sục khí $CO_2$ dư vào Y, thu được 8,58 gam kết tủa. Cho Z tan hết vào dung dịch $H_2SO_4$ (đặc, nóng), thu được dung dịch chứa 20,76 gam muối sunfat và 3,472 lít khí $SO_2$ (đktc). Biết $SO_2$ là sản phẩm khử duy nhất của $S^{+6}$ , các phản ứng xảy ra hoàn toàn. Giá trị của m là
Câu 37: Câu 37. Cho X, Y, Z là ba peptit mạch hở (phân tử có số nguyên tử cacbon tương ứng là 8, 9, 11; Z có nhiều hơn Y một liên kết peptit); T là este no, đơn chức, mạch hở. Chia 179,4 gam hỗn hợp E gồm X, Y, Z, T thành hai phần bằng nhau. Đốt cháy hoàn toàn phần một, thu được a mol $CO_2$ và (a – 0,09) mol $H_2O$. Thủy phân hoàn toàn phần hai bằng dung dịch $NaOH$ vừa đủ, thu được ancol metylic và 109,14 gam hỗn hợp G (gồm bốn muối của Gly, Ala, Val và axit cacboxylic). Đốt cháy hoàn toàn G, cần vừa đủ 2,75 mol $O_2$. Phần trăm khối lượng của Y trong E là
Câu 38: Câu 38. Hỗn hợp X gồm alanin, axit glutamic và axit acrylic. Hỗn hợp Y gồm propen và trimetylamin. Đốt cháy hoàn toàn a mol X và b mol Y thì tổng số mol oxi cần dùng vừa đủ là 1,14 mol, thu được $H_2O$; 0,1 mol $N_2$ và $0,91$ mol $CO_2$. Mặt khác, khi cho a mol X tác dụng với dung dịch $KOH$ dư thì lượng $KOH$ phản ứng là m gam. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
Câu 39: Câu 39. Este X hai chức, mạch hở, tạo bởi một ancol no với hai axit cacboxylic no, đơn chức. Este Y ba chức, mạch hở, tạo bởi glixerol với một axit cacboxylic không no, đơn chức (phân tử có hai liên kết pi). Đốt cháy hoàn toàn m gam hỗn hợp E gồm X và Y cần vừa đủ 0,5 mol $O_2$ thu được 0,45 mol $CO_2$. Mặt khác, thủy phân hoàn toàn 0,16 mol E cần vừa đủ 210 ml dung dịch $NaOH$ 2M, thu được hai ancol (có cùng số nguyên tử cacbon trong phân tử) và hỗn hợp ba muối, trong đó tổng khối lượng muối của hai axit no là a gam. Giá trị của a là
Câu 40: Câu 40. Hỗn hợp X gồm $Al_2O_3$, Ba, K (trong đó oxi chiếm 20% khối lượng của X). Hòa tan hoàn toàn m gam X vào nước dư, thu được dung dịch Y và 0,022 mol khí $H_2$. Cho từ từ đến hết dung dịch gồm 0,018 mol $H_2SO_4$ và 0,038 mol $HCl$ vào Y, thu được dung dịch Z (chỉ chứa các muối clorua và muối sunfat trung hòa) và 2,958 gam hỗn hợp kết tủa. Giá trị của m là