Thi thử THPT quốc gia môn Hóa Học online – Đề thi thử của sở GD&ĐT Nghệ An năm 2023 giúp bạn ôn tập kiến thức một cách có hệ thống thông qua hệ thống câu hỏi đa dạng. Các câu hỏi được sắp xếp từ dễ đến khó giúp bạn tiếp cận kiến thức từng bước. Đặc biệt phù hợp với những bạn đang ôn thi. Thông qua quá trình làm bài, bạn có thể nhận ra lỗ hổng kiến thức. Điều này giúp việc học trở nên chủ động hơn.
Thi thử THPT quốc gia môn Hóa Học online – Đề thi thử của sở GD&ĐT Nghệ An năm 2023
Câu 1: Hòa tan m gam hỗn hợp Al, Na vào lượng nước dư. Sau khi kết thúc phản ứng thu được 4,48 lít khí (đktc) và còn 0,2m gam chất rắn không tan. Giá trị của m là
Câu 2: Cho dãy các polime gồm: tơ tằm, tơ nitron, poli(metyl metacrylat), poli(vinyl clorua), tơ axetat, cao su buna, poli(etylen terephtalat). Số polime được tổng hợp từ phản ứng trùng hợp là
Câu 3: Nhiệt phân Fe(OH)2 trong không khí đến khi khối lượng chất rắn không thay đổi, thu được chất nào sau đây?
Câu 4: Natri hydroxit là hợp chất vô cơ của natri, tạo ra dung dịch bazơ mạnh khi hoà tan với nước. Natri hydroxit được sử dụng đặc biệt trong các phòng thí nghiệm cũng như trong công nghiệp. Công thức của natri hydroxit là
Câu 5: Công thức nào sau đây có thể là công thức của chất béo?
Câu 6: Trong công nghiệp, Al được sản xuất bằng phương pháp điện phân nóng chảy hợp chất nào sau đây?
Câu 7: Chất nào sau đây là chất điện li mạnh?
Câu 8: Phát biểu nào sau đây đúng?
Câu 9: Công thức cấu tạo thu gọn của etylamin là
Câu 10: Tính chất vật lí nào sau đây của kim loại không phải do các electron tự do gây ra?
Câu 11: Dãy các kim loại được xếp theo chiều giảm dần tính khử từ trái qua phải là
Câu 12: Khí X là một chất có tính oxi hóa mạnh, do vậy được sử dụng để xử lý nước, khử trùng, bảo quản thực phẩm… và có tác dụng bảo vệ các sinh vật trên Trái đất không bị bức xạ cực tím. Chất X có công thức phân tử là
Câu 13: Thủy phân este nào sau đây thì thu được hỗn hợp CH3OH và CH3COOH?
Câu 14: Trong công nghiệp, nhóm kim loại nào sau đây chỉ được điều chế bằng phương pháp điện phân nóng chảy?
Câu 15: Tên gọi thông thường của H2NCH2COOH là
Câu 16: Chất nào sau đây thuộc loại cacbohiđrat?
Câu 17: Fe chỉ tạo nên hợp chất Fe (II) khi tác dụng với chất nào sau đây?
Câu 18: Hợp chất nào sau đây không thể tham gia phản ứng trùng hợp?
Câu 19: Một nhà máy đường mỗi ngày ép 30 tấn mía. Biết 1 tạ mía cho 63 lít nước mía với nồng độ đường 7,5% và khối lượng riêng 1,103 g/ml. Giả sử hiệu suất của quá trình tinh chế là 100%. Khối lượng đường nhà máy sản xuất được mỗi ngày là
Câu 20: Hai kim loại đều thuộc nhóm IIA trong bảng tuần hoàn là
Câu 21: Cho các dung dịch: NaOH, CuCl2, AgNO3, HCl, HNO3. Có bao nhiêu dung dịch có thể oxi hóa Fe thành Fe+3?
Câu 22: Hấp thụ hoàn toàn 5,6 lít CO2 (đktc) vào 300ml dung dịch KOH 1M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X. Làm khô cẩn thận dung dịch X, thu được m gam chất rắn khan. Giá trị của m là
Câu 23: Cho 21 gam hỗn hợp gồm glyxin và axit axetic tác dụng vừa đủ với dung dịch KOH, thu được dung dịch X chứa 32,4 gam muối. Cho X tác dụng với dung dịch HCl dư, thu được dung dịch chứa m gam muối. Giá trị của m là
Câu 24: Các kim loại nào sau đây là thành phần của hợp kim dùng làm chất trao đổi nhiệt trong một số lò phản ứng hạt nhân?
Câu 25: Cho 1 mol triglixerit X tác dụng với dung dịch NaOH dư, thu được 1 mol glixerol, 2 mol natri stearat và 1 mol natri oleat. Phát biểu nào sau đây sai?
Câu 26: Kim loại nào sau đây không tan trong dung dịch HNO3 đặc nguội?
Câu 27: Các bước trong một quy trình làm rượu vang nho: Sau khi thu hoạch nho chín (nho chín có chứa hàm lượng đường lớn, thuận lợi cho quá trình lên men), trải qua khâu xử lí đơn giản, nho sẽ được tiến hành ép và lên men. Khí sinh ra trong quá trình lên men là
Câu 28: Ở điều kiện thường, kim loại nào sau đây không tan trong nước?
Câu 29: Sau khi phân tích thổ nhưỡng vùng đất trồng lạc (đậu phộng) của một tỉnh X, chuyên gia nông nghiệp khuyến nghị bà con nông dân cần bón bổ sung 40 kg N, 45 kg P và 66 kg K cho mỗi ha. Loại phân mà người nông dân sử dụng là phân hỗn hợp NPK (3 – 9 – 6) trộn với phân kali KCl (độ dinh dưỡng 60%) và ure (độ dinh dưỡng 46%). Theo khuyến nghị trên, tổng khối lượng phân bón đã sử dụng cho 1 ha gần nhất với giá trị nào sau đây?
Câu 30: Cho các phát biểu sau: (a) Tất cả các nguyên tố thuộc nhóm IIA đều dễ tan trong nước tạo dung dịch bazơ tương ứng. (b). Fe(NO3)2 bị AgNO3 trong dung dịch oxi hóa thành Fe3+. (c) Ở điều kiện thường, các kim loại đều ở trạng thái rắn. (d) Al, Al2O3 và Al(OH)3 đều tan được trong dung dịch NaOH. (e) Có thể dùng lượng vừa đủ dung dịch Ca(OH)2 để làm mềm nước cứng tạm thời. (g) Cho Fe3O4 dư vào dung dịch HCl thu được dung dịch chứa hỗn hợp 2 muối. Số phát biểu đúng là
Câu 31: Thực hiện sơ đồ phản ứng: Công thức cấu tạo của X là
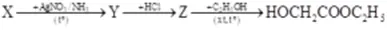
Câu 32: Cho dãy các chất sau: axit focmic, toluen, axetanđehit, saccarozơ, vinyl axetat, etylen glycol, glucozơ, alanin, isopren, phenyl amin, đivinyl, cumen. Tổng số chất tác dụng với dung dịch nước Br2 là
Câu 33: Hỗn hợp X1 gồm 4 este mạch hở, trong đó có 1 este đơn chức và ba este hai chức là đồng phân của nhau. Đốt cháy hết 11,88 gam X1 cần 0,66 mol O2, thu được 0,57 mol CO2. Đun nóng 11,88 gam X1 với 310 ml dung dịch NaOH 1M, cô cạn dung dịch sau phản ứng, thu được m gam chất rắn Y1 và phần hơi chỉ chứa 1 ancol đơn chức Z1. Cho hết lượng Z1 tác dụng với Na dư thì khối lượng bình chứa Na tăng 5,85 gam. Trộn m gam Y1 với CaO rồi nung nóng (không có mặt oxi), thu được 2,016 lít khí (đktc) một hiđrocacbon duy nhất. Biết các phản ứng xảy ra hoàn toàn. Công thức phân tử các este hai chức trong hỗn hợp X1 là
Câu 34: Tiến hành thí nghiệm theo các bước sau: - Bước 1: Cho từ từ dung dịch NH3 tới dư vào ống nghiệm (1) chứa 1 ml dung dịch AgNO3 đến khi kết tủa tan hết. - Bước 2: Thêm 0,5 ml dung dịch H2SO4 loãng vào ống nghiệm (2) chứa 2ml dung dịch saccarozơ 15%. Đun nóng dung dịch trong 3 – 5 phút. - Bước 3: Thêm từ từ dung dịch NaHCO3 vào ống nghiệm (2) khuấy đều đến khi không còn sủi bọt khí CO2. - Bước 4: Rót từ từ dung dịch trong ống nghiệm (2) vào ống nghiệm (1), đun nhẹ đến khi thấy kết tủa bám trên thành ống nghiệm. Cho các phát biểu dưới đây: (1) Sau bước 4, dung dịch trong ống nghiệm (1) có màu xanh lam. (2) Sau bước 2, dung dịch trong ống nghiệm (2) có hiện tượng phân lớp. (3) Dung dịch NaHCO3 trong bước 3 với mục đích loại bỏ H2SO4. (4) Sau bước 2, dung dịch trong ống nghiệm (2) chứa một monosaccarit. (5) Thí nghiệm trên chứng minh saccarozơ là có tính khử. (6) Phản ứng tráng gương trong bước 4 là phản ứng oxi hóa khử. Số phát biểu đúng là
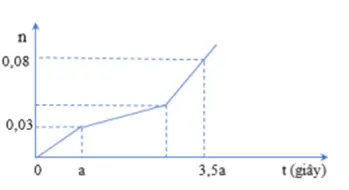
Câu 35: Hòa tan hỗn hợp gồm A gồm CuSO4 và NaCl vào nước thu được dung dịch X. Tiến hành điện phân X với điện cực trơ, màng ngăn xốp, dòng điện có cường độ không đổi. Tổng số mol khí thu được ở cả hai điện cực (n) phụ thuộc vào thời gian điện phân (t) được mô tả như đồ thị bên: Giả thiết hiệu suất điện phân là 100%, bỏ qua sự bay hơi của nước. % khối lượng của CuSO4 trong A là:
Câu 36: Cho m gam chất béo X chứa các triglixerit và axit béo tự do tác dụng vừa đủ với 250 ml dung dịch NaOH 1M, đun nóng thu được 70,9 gam hỗn hợp muối của các axit béo no. Mặt khác, đốt cháy hoàn toàn m gam X cần dùng 6,18 mol O2. Giá trị của m là
Câu 37: Tiến hành các thí nghiệm sau: (a) Dẫn khí x mol SO2 vào dung dịch chứa 3x mol NaOH. (b) Cho KMnO4 vào dung dịch HCl dư. (c) Cho dung dịch chứa a mol KHS vào dung dịch chứa a mol NaOH. (d) Hấp thụ hết 3 mol khí CO2 vào dung dịch chứa 2 mol Ca(OH)2. (e) Cho từ từ dung dịch chứa a mol HCl vào dung dịch chứa a mol Na2CO3. Số thí nghiệm thu được dung dịch có chứa hai muối là
Câu 38: Hỗn hợp X gồm axetilen, propilen và metan. Đốt cháy hoàn toàn 16,5 gam hỗn hợp X thu được 18,9 gam nước. Mặt khác 5,6 lít hỗn hợp X (đktc) phản ứng vừa đủ với dung dịch chứa 50 gam brom. Thành phần % thể tích của các chất trong hỗn hợp X lần lượt là
Câu 39: Biết khi đốt cháy 1 mol tristearin và 1 mol triolein toả ra lượng nhiệt lần lượt là 35 807 kJ và 34 950 kJ. Tính lượng nhiệt thu được khi đốt cháy 1 kg loại chất béo có 60% là tristearin và 30% triolein, còn lại tạp chất không sinh nhiệt.
Câu 40: Hòa tan hoàn toàn 17,46 gam hỗn hợp gồm AgNO3 và Cu(NO3)2.aH2O vào nước được dung dịch X. Nhúng thanh kim loại sắt vào dung dịch X, phản ứng kết thúc thấy khối lượng kim loại bám vào thanh sắt là m gam. Mặt khác, nhiệt phân hoàn toàn 17,46 gam hỗn hợp muối trên thu được 8,88 gam chất rắn Z. Để hòa tan hết lượng chất rắn Z cần dùng vừa đủ 61,25 ml dung dịch HNO3 12% (d = 1,2 g/ml) sau phản ứng thu được khí NO (sản phẩm khử duy nhất). Cho biết các phản ứng xảy ra hoàn toàn, giải thiết kim loại sinh ra đều bám hết trên thanh sắt. Xác định a và tính m.