Thi thử THPT quốc gia môn Hóa Học online – Đề thi minh họa năm 2018 của bộ GD&ĐT giúp bạn đánh giá chính xác mức độ hiểu bài thông qua nội dung bám sát chương trình học. Các câu hỏi được thiết kế khoa học giúp bạn học mà không cảm thấy áp lực. Đặc biệt phù hợp với học sinh muốn cải thiện điểm số. Thông qua quá trình làm bài, bạn có thể xác định phần kiến thức còn yếu. Điều này giúp việc học trở nên có mục tiêu rõ ràng hơn.
Thi thử THPT quốc gia môn Hóa Học online – Đề thi minh họa năm 2018 của bộ GD&ĐT
Câu 1: Kim loại nào sau đây có tính khử yếu nhất?
Câu 2: Chất nào sau đây làm mất tính cứng của nuóc cứng vĩnh cửu?
Câu 3: Trong các chất sau, chất gây ô nhiễm không khí có nguồn gốc từ khí thải sinh hoạt là
Câu 4: Este nào sau đây có phản ứng tráng bạc?
Câu 5: Công thức của sắt(II) hiđroxit là
Câu 6: Polime nào sau đây có cấu trúc mạch phân nhánh?
Câu 7: Chất nào sau đây vừa phản ứng với dung dịch HCl, vừa phản ứng vói dung dịch NaOH?
Câu 8: Crom có số oxi hóa +6 trong hợp chất nào sau đây?
Câu 9: Dung dịch nào sau đây có pH > 7?
Câu 10: Cacbon chỉ thể hiện tính khử trong phản ứng hóa học nào sau đây?
Câu 11: Chất nào sau đây là chất hữu cơ?
Câu 12: Cho vài giọt nước brom vào dung dịch phenol, lắc nhẹ thấy xuất hiện
Câu 13: Cho 4,48 lít khí CO (đktc) phản ứng với 8 gam một oxit kim loại, sau khi phản ứng hoàn toàn, thu được m gam kim loại và hỗn hợp khí có tỉ khối so với Ha là 20. Giá trị của m là
Câu 14: Cho 375 ml dung dịch NaOH 2M vào dung dịch chứa 0,2 mol AICI3, thu được m gam kết tủa. Giá trị của m là
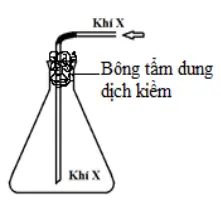
Câu 15: Trong phòng thí nghiệm, khí X được điều chế và thu vào bình tam giác bằng cách đẩy không khí như hình vẽ bên. Khí X là
Câu 16: Phát biểu nào sau đây sai?
Câu 17: Đốt cháy hoàn toàn hỗn hợp metyl axetat và etyl axetat, thu được CO2 và m gam H2O. Hấp thụ toàn bộ sản phẩm cháy vào dung dịch Ca(OH)2 dư, thu được 25 gam kết tủa. Giá trị của m là
Câu 18: Đốt cháy hoàn toàn amin X (no, đơn chức, mạch hở) bằng O2, thu được 4,48 lít CO2 và 1,12 lít N2 (các thể tích khí đo ở đktc). Công thức phân tử của X là
Câu 19: Cho sơ đồ phản ứng sau: Mỗi mũi tên là một phản ứng hóa học. Số phản ứng mà nitơ đóng vai trò chất khử là
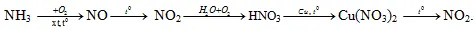
Câu 20: Cho các chất sau: etyl axetat, tripanmitin, saccarozo, etylamin, Gly-Ala. số chất tham gia phản ứng thủy phân trong môi trường kiềm là
Câu 21: Cho các phát biểu sau: (a) Điện phân dung dịch NaCl (điện cực trơ), thu được khí H2 ở catot. (b) Cho CO dư qua hồn hợp Al2O3 và CuO đun nóng, thu được AI và Cu. (c) Nhúng thanh Zn vào dung dịch chứa CuSO4 và H2SO4, có xuất hiện ăn mòn điện hóa. (d) Kim loại có nhiệt độ nóng chảy thấp nhất là Hg, kim loại dẫn điện tốt nhất là Ag. (e) Cho dung dịch AgNO3 dư vào dung dịch FeCl2, thu được chất rắn gồm Ag và AgCl. Số phát biểu đúng là
Câu 22: Cho este đa chức X (có công thức phân tử C6H10O4) tác dụng vói dung dịch NaOH, thu được sản phẩm gồm một muối của axit cacboxylic Y và một ancol z. Biết X không có phản ứng tráng bạc Số công thức cấu tạo phù hợp của X là
Câu 23: Cho m gam P2O5 vào dung dịch chứa 0,1 mol NaOH và 0,05 mol KOH, thu được dung dịch X. Cô cạn X, thu được 8,56 gam hồn hợp chất rắn khan. Giá trị của m là
Câu 24: Hỗn hợp E gồm muối vô co X (CH8N2O3) và đipeptit Y (C4H8N2O3). Cho E tác dụng với dung dịch NaOH đun nóng, thu được khí z. Cho E tác dụng với dung dịch HC1 dư, thu được khí T và chất hữu cơ. Nhận định nào sau đây sai?
Câu 25: Hòa tan hoàn toàn Fe3O4 trong dung dịch H2SO4 (loãng, dư), thu được dung dịch X. Cho dãy gồm các chất: Cu, Fe(NO3)2, KMnO4, BaCl2, Cl2, KNO3, NaCl. số chất trong dãy phản ứng được với dung dịch X là
Câu 26: Lên men m gam tinh bột thành ancol etylic vói hiệu suất 81%, hấp thụ toàn bộ khí C02 sinh ra vào dung dịch chứa 0,05 mol Ba(OH)2, thu được kết tủa và dung dịch X. Cho từ từ dung dịch NaOH vào X, đến khi kết tủa lớn nhất thì cần ít nhất 10 ml dung dịch NaOH IM. Giá trị của m là
Câu 27: Cho so đồ chuyển hóa sau: Biết X, Y, z, T là các hợp chất của crom. Chất z và T lần lượt là
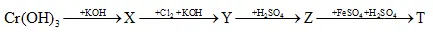
Câu 28: Tiến hành thí nghiệm vói các dung dịch X, Y, z và T. Kết quả được ghi ở bảng sau: Mẩu thử Thuốc thử Hiện tượng Y Quỳ tím Quỳ chuyển sang màu xanh x,z Dung dịch AgNO3 trong NH3, đun nóng Tạo kết tủa Ag T Dung dịch Bi'2 Kết tủa trắng z Cu(OH)2 Tạo dung dịch màu xanh lam X, Y, Z, T lần lượt là:
Câu 29: Tiến hành các thí nghiệm sau: (a) Cho dung dịch chứa 4a mol HC1 vào dung dịch chứa a mol NaAlCl. (b) Cho Al2O3 vào lượng dư dung dịch NaOH (c) Sục khí CO2 đến dư vào dung dịch Ba(OH)2. (d) Cho Fe vào dung dịch Fe2(SO4)3 dư. (e) Cho dung dịch chứa a mol KHSO4 vào dung dịch chứa a mol NaHCO3. (g) Cho Mg dư vào dung dịch HNO3 (phản ứng không thu được chất khí). Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được dung dịch chứa hai muối là
Câu 30: Cho 3,2 gam hồn hợp C2H2, C3H8, C2H6, C4H6 và H2 đi qua bột Ni nung nóng, sau một thời gian thu được hỗn hợp khí X. Đốt cháy hoàn toàn X cần vừa đủ V lít khí O2 (đlctc), thu được 4,48 lít CO2 (đktc). Giá trị của V là
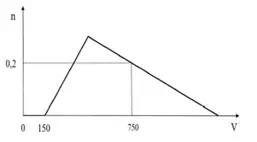
Câu 31: Cho từ từ dung dịch HCl IM vào dung dịch chứa X mol NaOH và y mol NaAlO2. số n mol Al(OH)3 (n mol) tạo thành phụ thuộc vào thể tích dung dịch HCl (V ml) được biểu diễn bằng đồ thị bên. Giá trị của X và y lần lượt là
Câu 32: Cho các chất sau: metan, etilen, buta-1,3-dien, benzen, toluen, stiren, phenol, metyl acrylat. Số chất tác dụng được với nước brom ở điều kiện thường là
Câu 33: Điện phân (điện cực tro, màng ngăn xốp) dung dịch gồm CuSO4 và NaCl (tỉ lệ mol tưong ứng 1 : 3) với cường độ dòng điện l,34A. Sau thòi gian t giờ, thu được dung dịch Y (chứa hai chất tan) có khối lượng giảm 10,375 gam so vói dung dịch ban đầu. Cho bột AI dư vào Y, thu được 1,68 lít khí H2 (đlctc). Biết các phản ứng xảy ra hoàn toàn, hiệu suất điện phân 100%, bỏ qua sự hòa tan của khí trong nước và sự bay hoi của nước. Giá trị của t là
Câu 34: Đốt cháy hoàn toàn a gam este hai chức, mạch hở X (được tạo bởi axit cacboxylic no và hai ancol) cần vừa đủ 6,72 lít khí O2 (đktc), thu được 0,5 mol hỗn hợp CO2 và H2O. Cho a gam X phản ứng hoàn toàn với 200 ml dung dịch NaOH IM, thu được dung dịch Y. Cô cạn Y, thu được m gam chất rắn khan. Giá trị của m là
Câu 35: Hòa tan hoàn toàn m gam hỗn hợp X gồm Ba, BaO, Al và AI2O3 vào nước (dư), thu được 0,896 lít khí (đktc) và dung dịch Y. Hấp thụ hoàn toàn 1,2096 lít khí CO2 (đlctc) vào Y, thu được 4,302 gam kết tủa. Lọc kết tủa, thu được dung dịch z chỉ chứa một chất tan. Mặt khác, dẫn từ từ CO2 đến dư vào Y thì thu được 3,12 gam kết tủa. Giá trị của m là
Câu 36: Hỗn hợp X chứa hai amin kế tiếp thuộc dãy đồng đẳng của metylamin. Hỗn hợp Y chứa glyxin và lysin. Đốt cháy hoàn toàn 0,2 mol hồn hợp z (gồm X và Y) cần vừa đủ 1,035 mol O2, thu được 16,38 gam H2O; 18,144 lít (đktc) hỗn hợp CO2 và N2. Phần trăm khối lượng của amin có khối lượng phân tử nhỏ hon trong z là
Câu 37: Hỗn hợp X gồm Fe2O3, FeO và Cu (trong đó nguyên tố oxi chiếm 16% theo khối lượng). Cho m gam X tác dụng với 500 ml dung dịch HCl 2M (dư), thu được dung dịch Y và còn lại 0,27m gam chất rắn không tan. Cho dung dịch AgNO.3 dư vào Y, thu được khí NO (sản phẩm khử duy nhất của N+5) và 165,1 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
Câu 38: Cho hỗn hợp z gồm peptit mạch hở X và amino axit Y (Mx> 4My) vói tỉ lệ mol tưong ứng 1:1. Cho m gam z tác dụng vừa đủ vói dung dịch NaOH, thu được dung dịch T chứa (m + 12,24) gam hỗn hợp muối natri của glyxin và alanin. Dung dịch T phản ứng tối đa với 360 ml dung dịch HCl 2M, thu được dung dịch chứa 63,72 gam hỗn hợp muối. Các phản ứng xảy ra hoàn toàn. Kết luận nào sau đây đúng?
Câu 39: Hòa tan hoàn toàn 15,6 gam hỗn hợp gồm Fe, Fe3O4, Fe2O3, Mg, MgO và CuO vào 200 gam dung dịch H2SO4 và NaNO3, thu được dung dịch X chỉ chứa muối sunfat trung hòa của kim loại, hồn hợp khí Y gồm 0,01 mol N2O và 0,02 mol NO. Cho X phản ứng với dung dịch Ba(OH)2 dư, thu được 89,15 gam kết tủa. Lọc kết tủa nung trong không khí đến khối lượng không đổi, thu được 84,386 gam chất rắn. Nồng độ phần trăm của FeS04 trong X có giá trị gần nhất với giá trị nào sau đây?
Câu 40: Cho các chất hữu co mạch hở: X là axit không no có hai liên kết 71 trong phân tử, Y là axit no đơn chức, z là ancol no hai chức, T là este của X, Y với z. Đốt cháy hoàn toàn a gam hỗn hợp M gồm X và T, thu được 0,1 mol CO2 và 0,07 mol H2O. Cho 6,9 gam M phản ứng vừa đủ với dung dịch NaOH, cô cạn dung dịch sau phản ứng thu được hỗn hợp muối khan E. Đốt cháy hoàn toàn E, thu được Na2CO3; 0,195 mol CO2 và 0,135 mol H2O. Phần trăm khối lượng của T trong M có giá trị gần nhất với giá trị nào sau đây?