Đề thi thử THPT QG năm 2022 môn Hóa học online – Đề thi của Trường THPT Trương Định giúp bạn ôn tập kiến thức một cách có hệ thống thông qua hệ thống câu hỏi đa dạng. Các câu hỏi được sắp xếp từ dễ đến khó giúp bạn tiếp cận kiến thức từng bước. Đặc biệt phù hợp với những bạn đang ôn thi. Thông qua quá trình làm bài, bạn có thể nhận ra lỗ hổng kiến thức. Điều này giúp việc học trở nên chủ động hơn.
Đề thi thử THPT QG năm 2022 môn Hóa học online – Đề thi của Trường THPT Trương Định
Câu 1: Để tạo độ xốp cho một số loại bánh, có thể dùng muối nào sau đây làm bột nở?
Câu 2: Etyl axetat có công thức cấu tạo thu gọn là
Câu 3: Polime được điều chế bằng phản ứng trùng ngưng là gì?
Câu 4: Muốn bảo quản kim loại kiềm, người ta ngâm chúng trong
Câu 5: Chất nào sau đây tác dụng với dung dịch NaOH thu được glixerol?
Câu 6: Cho 33,4 gam hỗn hợp chất rắn X gồm Mg, MgO, Fe(NO3)2 và FeCO3 vào dung dịch chứa 1,29 mol HCl và 0,166 HNO3, sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y chỉ chứa các muối và 0,163 mol hỗn hợp khí Z gồm N2O, N2 và 0,1 mol CO2. Cho dung dịch AgNO3 dư vào Y, thu được 191,595 gam kết tủa. Mặt khác, để tác dụng tối đa với cấc chất trong dung dịch Y cần 1,39 mol KOH trong dung dịch. Biết rằng tổng số mol nguyên tử oxi có trong X là 0,68 mol. Số mol của N2 có trong Z là
Câu 7: Tên gọi của hợp chất có công thứcc cấu tạo $C{{H}_{2}}=C(C{{H}_{3}})CH=C{{H}_{2}}$ là
Câu 8: Ancol nào sau đây có số nguyên tử cacbon bằng số nhóm −OH?
Câu 9: Kim loại có khối lượng riêng nhỏ nhất là
Câu 10: Polime nào sau đây được điều chế bằng phản ứng trùng hợp?
Câu 11: Khi bị nhiệt phân, muối nitrat nào sau đây tạo sản phẩm là kim loại?
Câu 12: Dung dịch NaHCO3 không tác dụng với dung dịch
Câu 13: Kim loại nào dưới đây không tan trong nước ở điều kiện thường?
Câu 14: Thủy phân hoàn toàn xenlulozo trong môi trường axit, thu được chất nào sau đây?
Câu 15: Chất nào dưới đây khi tác dụng với dung dịch HCl thu được hai muối?
Câu 16: Trong các cặp chất dưới đây, cặp chất nào cùng tồn tại trong một dung dịch?
Câu 17: X là một loại tơ. Một mắt xích cơ bản của X có khối lượng là 226u (hau đvC). X có thể là
Câu 18: Cho hỗn hợp gồm K2O, BaO, Al2O3 và FeO vào lượng nước dư, thu được dung dịch X và chất rắn Y. Sục khí CO2 đến dư vào dung dịch X, thu được kết tủa là
Câu 19: Khi thủy phân không hoàn toàn pentapeptit $Ala-Gly-Val-Gly-Ala$ được tối đa bao nhiêu tripeptit khác nhau?
Câu 20: Số hidrocacbon thơm có cùng công thức phân tử C8H10 bằng
Câu 21: Silic phản ứng được với tất cả các chất trong dãy nào dưới đây?
Câu 22: Phát biểu nào sau đây là sai?
Câu 23: Nước thải công nghiệp thường chứa con ion kim loại nặng như Hg2+, Pb2+, Fe3+,... Để xử lí sơ bộ nước thải trên, làm giảm nồng độ các ion kim loại nặng với chi phí thấp, người ta sử dụng chất nào sau đây?
Câu 24: Andehit axetic thể hiện tính oxi hóa trong phản ứng nào sau đây?
Câu 25: Thủy phân hoàn toàn triglixerit X trong dung dịch NaOH, thu được glixerol, natri stearat và natri oleat. Đốt cháy hoàn toàn m gam X thu được H2O và 9,12 mol CO2. Mặt khác, m gam X tác dụng hoàn toàn với H2 dư (xúc tác Ni, nung nóng) thu được chất béo Y. Đem toàn bộ Y tác dụng hoàn toàn với NaOH vừa đủ, rồi thu lấy toàn bộ muối sau phản ứng đốt cháy trong oxi dư thì thu được tối đa a gam H2O. Giá trị của a gần nhất với giá trị nào sau đây?
Câu 26: Xét các phát biểu sau: (a) Kim loại Na phản ứng mạnh với nước; (b) Khí N2 tan rất ít trong nước; (c) Khí NH3 tạo khói trắng khi tiếp xúc với khi HCl; (d) P trắng phát quang trong bóng tối; (e) Thành phần chính của phân supephotphat kép là Ca(H2PO4)2 và CaSO4. Số phát biểu đúng là
Câu 27: Có các phát biểu sau: (a) H2NCH2COHNCH2CH2COOH có chứa 1 liên kết peptit trong phân tử; (b) Etylamin, metylamin ở điều kiện thường đều là chất khí, có mùi khai, độc; (c) Benzenamin làm xanh quỳ ẩm; (d) Các peptit, glucozo, saccarozo đều tạo phức với Cu(OH)2; (e) Thủy phân đến cùng protein đơn giản chỉ thu được các $\alpha -\text{amino ax}it$; (f) Protein được tạo nên từ các chuỗi peptit kết hợp lại với nhau. Số phát biểu đúng là
Câu 28: Cho chất X (CrO3) tác dụng với lượng dư dung dịch NaOH, thu được hợp chất Y của crom. Đem chất Y cho vào dung dịch H2SO4 loãng, dư, thu được hợp chất Z của crom. Đem chất Z tác dụng dung dịch HCl dư, thu được khí T. Phát biểu nào sau đây không đúng?
Câu 29: Cho các phát biểu sau: (a) Các kim loại Na, K và Al đều phản ứng mạnh với nước; (b) Dung dịch muối Fe(NO3)2, tác dụng được với dung dịch HCl; (c) P cháy trong Cl2 có thể tạo thành PCl3 và PCl5; (d) Than chì được dùng làm điện cực, chế tạo chất bôi trơn, làm bút chì đen; (e) Hỗn hợp Al và NaOH (tỉ lệ số mol 1.1) tan hoàn toàn trong nước dư; (g) Người ta không dùng CO2 để dập tắt đám cháy magie hoặc nhôm. Số phát biểu đúng là
Câu 30: Đốt môi sắt chứa kim loại M cháy ngoài không khí rồi đưa vào bình đựng khí CO2 (như hình vẽ). Thấy kim loại M tiếp tục cháy trong bình khí đựng CO2. Kim loại M là
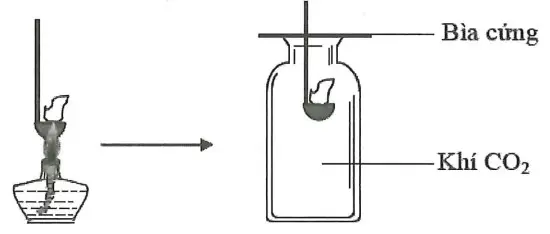
Câu 31: Cho dãy các chất: NH4Cl, (NH4)2SO4, NaCl, MgCl2, FeCl2, AlCl3. Số chất trong dãy tác dụng với lượng dư dung dịch Ba(OH)2 tạo thành kết tủa là
Câu 32: Cho 0,1 mol andehit X phản ứng tối đa với 0,3 mol H2, thu được 9 gam ancol Y. Mặt khác 2,1 gam X tác dụng hết với lượng dư dung dịch AgNO3 trong NH3, thu được m gam Ag. Giá trị của m là
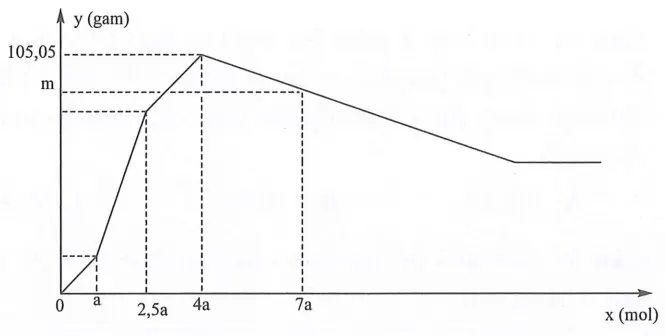
Câu 33: Nhỏ từ từ đến dư dung dịch H2SO4 vào dung dịch chứa đồng thời NaAlO2, Ba(AlO2)2, Ba(OH)2. Sự phụ thuộc của khối lượng kết tủa (y gam) vào số mol H2SO4 tham gia phản ứng (x mol) được biểu diễn bằng đồ thị sau: Giá trị m là
Câu 34: Đốt cháy hoàn toàn một lượng este X (no, đơn chức, mạch hở) thì số mol O2 phản ứng bằng số mol CO2 sinh ra. Mặt khác, cho 6,0 gam X tác dụng vừa đủ với dung dịch KOH, thu được dung dịch chứa m gam muối. Giá trị của m là
Câu 35: Hỗn hợp X chứa Al và Na có khối lượng a gam. Cho hỗn hợp X vào lượng nước dư, thấy thoát ra 4,48 lít khí H2. Nếu cho hỗn hợp X vào lượng KOH dư, thấy thoát ra 7,84 lít khí H2. Các thể tích khí đo ở điều kiện chuẩn. Giá trị của a là
Câu 36: Cho 6,3 gam hỗn hợp X gồm axit axetic, axit propionic và axit acrylic vừa đủ để làm mất màu hoàn toàn dung dịch chứa 6,4 gam brom. Để trung hoàn toàn 3,15 gam hỗn hợp X cần 90 ml dung dịch NaOH 0,5M. Thành phần phần trăm khối lương của axit axetic trong hỗn hợp X là
Câu 37: Cho 7,35 gam axit glutamic và 15 gam glyxin vào dung dịch chứa 0,3 mol KOH, thu được dung dịch Y. Cho Y tác dụng hoàn toàn với dụng dịch HCl dư, thu được m gam muối. Giá trị của m là
Câu 38: Điện phân 200 ml dung dịch CuSO4 1,0 M và NaCl a M (điện cực trơ, màng ngăn xốp, hiệu suất điện phân 100%, bỏ qua sự hòa tan của khí trong nước và sự bay hơi của nước) với cường độ dòng điện không đổi 2A trong thời gian 14475 giây. Dung dịch thu được có khối lượng giảm 14,75 gam so với dung dịch ban đầu. Giá trị của a là
Câu 39: Cho 0,15 mol bột Cu và 0,3 mol Fe(NO3)2 vào dung dịch chứa 0,5 mol H2SO4 (loãng). Sau khi các phản ứng xảy ra hoàn toàn, thu được V lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của V là
Câu 40: Hỗn hợp X gồm Ba, BaO và Ba(OH)2 có tỉ lệ số mol tương ứng 1.2.3. Cho m gam X vào nước thì thu được a lít dung dịch Y và V lít khí H2 (đktc). Hấp thụ 8V lít CO2 (đktc) vào a lít dung dịch Y đến phản ứng xảy ra hoàn toàn thì thu được 98,5 gam kết tủa. Giá trị của m là