Đề thi thử THPT QG năm 2022 môn Hóa học online – Đề thi của Trường THPT Nguyễn Văn Cừ giúp bạn nhận biết điểm mạnh và điểm yếu của bản thân thông qua dạng bài tập quen thuộc thường gặp trong đề thi. Các câu hỏi được xây dựng theo lộ trình giúp bạn tự tin hoàn thành bài quiz. Đặc biệt phù hợp với người học muốn tự đánh giá năng lực. Thông qua quá trình làm bài, bạn có thể điều chỉnh phương pháp học tập cho phù hợp. Điều này giúp việc học trở nên tiết kiệm thời gian hơn.
Đề thi thử THPT QG năm 2022 môn Hóa học online – Đề thi của Trường THPT Nguyễn Văn Cừ
Câu 1: Kim loại thường dùng làm chất trao đổi nhiệt trong phản ứng hạt nhân là
Câu 2: Kim loại nào sau đây có thể điều chế bằng phương pháp điện phân dung dịch?
Câu 3: Kim loại nào sau đây phản ứng được với dung dịch NaOH?
Câu 4: Trong các tác nhân hóa học gây ô nhiễm môi trường nước có ion của kim loại nặng nào sau đây?
Câu 5: Kim loại không phản ứng được với dung dịch Pb(NO3)2 loãng là
Câu 6: Cho dung dịch NaOH vào dung dịch chứa chất X, thu được kết tủa màu xanh. Chất X là
Câu 7: Bột nhôm tự bốc chảy khi tiếp xúc với
Câu 8: Trong các hợp chất, kim loại kiềm có số oxi hóa bằng?
Câu 9: Muối ngậm nước CaSO4.2H2O được gọi là
Câu 10: Chất nào sau đây không tác dụng với dung dịch HCl?
Câu 11: Ở nhiệt độ thường, crom chỉ tác dụng với
Câu 12: Khi làm thí nghiệm với HNO3 đặc, nóng trong ống nghiệm, thường sinh ra khí NO2 rất độc. Để loại bỏ khí NO2 thoát ra gây ô nhiễm môi trường, người ta nút ống nghiệm bằng bông tẩm dung dịch nào sau đây?
Câu 13: Este X được tạo thành trực tiếp từ axit fomic và ancol etylic có công thức phân tử là
Câu 14: Thủy phân hoàn toàn một lượng tristearin trong dung dịch NaOH (vừa đủ), thu được 1 mol glixerol và
Câu 15: Trong quả chuối xanh có chứa nhiều cacbohiđrat nào sau đây?
Câu 16: Chất nào dưới đây tạo kết tủa trắng với nước brom?
Câu 17: Dung dịch chứa chất nào sau đây làm quỳ tím chuyển màu xanh?
Câu 18: Tơ tằm thuộc loại
Câu 19: Để tạo độ xốp cho bánh mì, trong quá trình nhào bột bánh, người ta cho thêm chất nào sau đây?
Câu 20: Glixerol có công thức là
Câu 21: Cho các chất sau: Fe2O3, Cr2O3, Cr(OH)3, Fe(NO3)2. Số chất phản ứng được với dung dịch NaOH loãng là
Câu 22: Dầu thực vật hầu hết là lipit ở trạng thái lỏng do
Câu 23: Hòa tan hết 10,8 gam Al trong dung dịch HNO3 loãng, không thấy khí thoát ra. Số mol HNO3 đã phản ứng là
Câu 24: Nhận định nào sau đây là sai?
Câu 25: Hòa tan hoàn toàn m gam hỗn hợp Mg và MgO vào dung dịch HCl dư, thu được 8,96 lit khí H2 và 57 gam muối. Giá trị của m là
Câu 26: Dãy các chất tác dụng với dung dịch NaOH đun nóng, thu được ancol là
Câu 27: Chọn phát biểu đúng?
Câu 28: Cho dung dịch chứa m gam hỗn hợp gồm glucozơ và fructozơ tác dụng với lượng dung dịch AgNO3/NH3, đun nóng thu được 38,88 gam Ag. Giá trị m là
Câu 29: Hỗn hợp X gồm metylamin và đimetylamin có tỉ khối so với metan bằng 2,4625. Lấy 7,88 gam X tác dụng với dung dịch HCl loãng, dư thư được m gam muối. Giá trị của m là
Câu 30: Cho các polime sau: polietilen, nilon-6,6, poliacrylonitrin, poli(etilen-terephtalat), poli(metyl metacrylat). Số polime trùng ngưng là
Câu 31: Đốt cháy hoàn toàn x mol hỗn hợp E gồm CH4, C2H4, C3H6 và C2H2, thu được 8,064 lít CO2 (đktc) và 7,56 gam H2O. Mặt khác, cho 6,192 gam E phản ứng được với tối đa 0,168 mol Br2 trong dung dịch. Giá trị của x là
Câu 32: Thực hiện các thí nghiệm sau: (a) Cho Mg vào lượng dư dung dịch FeSO4. (b) Cho dung dịch NaOH vào dung dịch Fe(NO3)3. (c) Dẫn luồng khí NH3 qua bột CuO, nung nóng. (d) Nhiệt phân AgNO3. (e) Điện phân nóng chảy NaCl (điện cực trơ). (g) Cho Na vào lượng dư dung dịch CuSO4 dư. Sau khi kết thúc các phản ứng, số thí nghiệm thu được kim loại là
Câu 33: Hỗn hợp X gồm C6H12O6, CH3COOH, C2H4(OH)2 và HO-CH2-CH2-COOH. Đốt cháy hoàn toàn m gam X, thu được 26,84 gam CO2 và 13,14 gam H2O. Giá trị m là
Câu 34: Cho các phát biểu sau: (a) Xenlulozơ trinitrat được dùng để chế tạo thuốc súng không khói. (b) Axit glutamic được dùng làm thuốc hỗ trợ thần kinh. (c) Poli(vinyl clorua) là polime có tính cách nhiệt, cách điện. (d) Trimetylamin là chất khí, có mùi khai, tan nhiều trong nước. (e) Dung dịch phenol làm quỳ tím hóa đỏ. (g) Axit axetic tan vô hạn trong nước. Số phát biểu đúng là
Câu 35: Hòa tan hoàn toàn hỗn hợp gồm Na, Na2O, Ba, BaO bằng lượng nước dư, thu được dung dịch X. Sục 0,32 mol CO2 vào X thu được dung dịch Y chỉ chứa các ion Na+, HCO3-, CO32- và kết tủa Z. Chia Y thành hai phần bằng nhau. Cho từ từ phần 1 vào 200 ml dung dịch HCl 0,6M thu được 0,075 mol CO2. Mặt khác, nhỏ từ từ 200 ml HCl 0,6M vào phần 2 thu được 0,06 mol CO2. Cho toàn bộ X vào 150 ml dung dịch Al2(SO4)3 0,5M thu được m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m gần nhất với giá trị nào sau đây?
Câu 36: Hỗn hợp X gồm hai amin (no, đơn chức, mạch hở, đồng đẳng kế tiếp) và hai hiđrocacbon (mạch hở, thể khí ở điều kiện thường, có cùng số nguyên tử H trong phân tử). Đốt cháy hoàn toàn 5,6 lít X cần vừa đủ 19,656 lít O2 thu được H2O, 29,92 gam CO2 và 0,56 lít N2. Các thể tích khí được đo ở điều kiện tiêu chuẩn. Phần trăm thể tích của amin có phân tử khối lớn hơn trong X là
Câu 37: Hòa tan hoàn toàn 34,24 gam hỗn hợp X gồm FeCO3, Fe3O4 và Fe(NO3)2 trong dung dịch chứa NaNO3 và NaHSO4, kết thúc phản ứng thu được dung dịch Y (không chứa muối amoni) và hỗn hợp khí Z gồm CO2 và NO (tỉ lệ mol tương ứng 1 : 3). Dung dịch Y hòa tan tối đa 8,4 gam bột Fe (không có khí thoát ra). Nếu cho dung dịch Ba(OH)2 dư vào Y, thu được 209,18 gam kết tủa. Phần trăm khối lượng của Fe3O4 trong X là
Câu 38: Thủy phân hoàn toàn m gam chất béo E cần vừa đủ 150 ml dung dịch KOH 0,5M, thu được dung dịch chứa a gam muối X và b gam muối Y (MX < MY, trong mỗi phân tử muối có không quá ba liên kết π, X và Y có cùng số nguyên tử C, số mol của X lớn hơn số mol của Y). Mặt khác, đốt cháy hoàn toàn m gam E, thu được 28,56 lít CO2 (đktc) và 20,25 gam H2O. Giá trị của a và b lần lượt là
Câu 39: Hỗn hợp T gồm ba este đơn chức X, Y, Z (MX < MY < MZ, Y hơn X một nguyên tử C, Y chiếm 20% số mol trong T). Hóa hơi 14,28 gam T thu được thể tích đúng bằng thể tích của 6,4 gam O2 trong cùng điều kiện. Mặt khác 14,28 gam T tác dụng vừa đủ với 220 ml dung dịch NaOH 1M thu được dung dịch Q chứa bốn muối. Cô cạn Q thu được hỗn hợp muối khan R. Phần trăm khối lượng muối của cacboxylic có phân tử khối lớn nhất trong R là
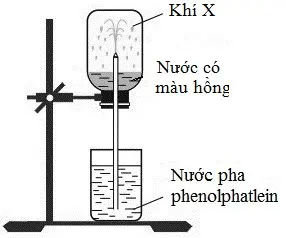
Câu 40: Ở điều kiện thường, thực hiện thí nghiệm với khí X như sau: Nạp đầy khí X vào bình thủy tinh rồi đậy bình bằng nắp cao su. Dùng ống thủy tinh vuốt nhọn đầu nhúng vào nước, xuyên ống thủy tinh qua nắp cao su rồi lắp bình thủy tinh lên giá như hình vẽ: Cho phát biểu sau: (a) Khí X có thể là HCl hoặc NH3. (b) Thí nghiệm trên để chứng minh tính tan tốt của HCl trong nước. (c) Tia nước phun mạnh vào bình thủy tinh do áp suất trong bình cao hơn áp suất không khí. (d) Trong thí nghiệm trên, nếu thay thuốc thử phenolphtalein bằng quỳ tím thì nước trong bình sẽ có màu xanh. (e) Khí X có thể là metylamin hoặc etylamin. (g) So với điều kiện thường, khí X tan trong nước tốt hơn ở điều kiện 60°C và 1 amt. (h) Có thể thay nước cất chứa phenolphtalein bằng dung dịch NH3 bão hòa chứa phenolphtalein. Số phát biểu đúng là