Đề thi thử THPT QG năm 2022 môn Hóa học online – Đề thi của Trường THPT Nguyễn Thái Bình giúp bạn luyện tập thường xuyên để ghi nhớ lâu hơn thông qua các câu hỏi được chọn lọc kỹ lưỡng. Các câu hỏi được phân bổ hợp lý theo mức độ nhận thức giúp bạn không bị quá tải. Đặc biệt phù hợp với người chuẩn bị cho các kỳ kiểm tra quan trọng. Thông qua quá trình làm bài, bạn có thể biết được nội dung nào cần ôn lại. Điều này giúp việc học trở nên hiệu quả hơn.
Đề thi thử THPT QG năm 2022 môn Hóa học online – Đề thi của Trường THPT Nguyễn Thái Bình
Câu 1: Trộn KMnO4 và KClO3 với một lượng bột MnO2 trong bình kính thu được hỗn hợp X. Lấy 52,550 gam X đem nung nóng , sau một thời gian thu được hỗn hợp chất rắn Y và V lít khí O2. Biết KClO3 bị nhiệt phân hoàn toàn tạo 14,9 gam KCl chiếm 36,315% khối lượng Y. Sau đó cho toàn bộ Y tác dụng hoàn toàn với axit HCl đặc du đung nóng , sau phản ứng cô cạn dung dịch thu được 51,275 gam muối khan. Hiệu suất của quá trình nhiệt phân muối KMnO4 trong X là :
Câu 2: Hỗn hợp X gồm hiđro, propen, axit acrylic, ancol anlylic (C3H5OH). Đốt cháy hoàn toàn 1,0 mol X thu được 39,6 gam CO2. Đun nóng X với Ni một thời gian, thu được hỗn hợp Y. Tỉ khối của Y so với X bằng 1,25. Cho 0,32mol Y phản ứng vừa đủ với V lít dung dịch Br2 0,1M. Giá trị của V là
Câu 3: Có các phát biểu sau: (1) Thủy phân chất béo trong môi trường kiềm luôn thu được glixerol. (2) Triolein làm mất màu nước brom. (3) Chất béo không tan trong nước và nhẹ hơn nước. (4) Benzyl axetat là este có mùi chuối chín. (5) Đốt cháy etyl axetat thu được số mol nước bằng số mol khí cacbonic. Số phát biểu đúng là:
Câu 4: X, Y là hai hữu cơ axit mạch hở. Z là ancol no, T là este hai chức mạch hở không nhánh tạo bởi X, Y, Z. Đun 29,145 gam hỗn hợp E chứa X, Y, Z, T với 300 ml dung dịch NaOH 1M vừa đủ thu được ancol Z và hỗn hợp F chứa hai muối có số mol bằng nhau. Cho Z vào bình chứa Na dư thấy bình tăng 14,43 gam và thu được 4,368 lít H2 (ở đktc). Đốt hoàn toàn hỗn hợp F cần 11,76 lít O2 (đktc) thu được khí CO2, Na2CO3 và 5,4 gam H2O. Phần trăm khối lượng của T trong E là
Câu 5: Hỗn hợp X chứa hai amin kế tiếp thuộc dãy đồng đẳng của metylamin. Hỗn hợp Y chứa glyxin và lysin. Đốt cháy hoàn toàn 0,4 mol hỗn hợp Z (gồm X và Y) cần vừa đủ 2,055 mol O2, thu được 32,22 gam H2O, 35,616 lít (đktc) hỗn hợp CO2 và N2. Phần trăm khối lượng của amin có khối lượng phân tử nhỏ hơn trong Z là
Câu 6: X là este của a-aminoaxit có công thức phân tử C5H11O2N; Y và Z là hai peptit mạch hở được tạo bởi glyxin và alanin có tổng số liên kết peptit là 7. Đun nóng 63,5 gam hỗn hợp E chứa X, Y, Z với dung dịch NaOH vừa đủ, thu được hỗn hợp chứa 2 muối và 13,8 gam ancol T. Đốt cháy toàn bộ hỗn hợp muối cần dùng 2,22 mol O2, thu được Na2CO3, CO2, H2O và 7,84 lít khí N2 (đktc). Phần trăm khối lượng của peptit có khối lượng phân tử lớn trong hỗn hợp E là
Câu 7: Cho hỗn hợp X gồm 0,15 mol P2O5, 0,15 mol K2O, 0,1 mol Na2O vào nước dư thu được dung dịch Y chứa m (gam) muối. Giá trị của m là :
Câu 8: Hỗn hợp X gồm Fe2O3 và Cu . Cho m gam hỗn hợp X tan hết trong dung dịch HCl vừa đủ thu được dung dịch Y chứa 122,76 gam chất tan. Cho m gam hỗn hợp X tác dụng với dung dịch H2SO4 loãng vừa đủ thu được dung dịch Z chứa 3 chất tan với tỉ lệ số mol 1:2:3. Dung dịch Y làm mất màu tối đa bao nhiêu gam KMnO4 trong môi trường H2SO4?
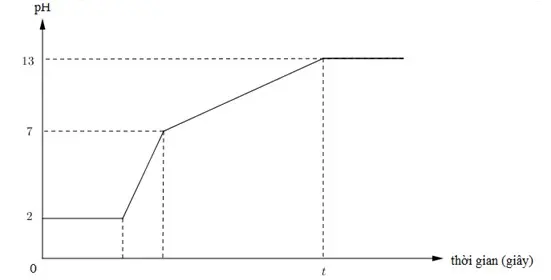
Câu 9: Dưới đây là đồ thị biểu diễn mối quan hệ giữa thời gian điện phân và pH của dung dịch khi điện phân 400ml (xem thể tích không đổi) dung dịch gồm KCl, HCl và CuCl2 0,02M (điện cực trơ, màng ngăn xốp) với cường độ dòng điện bằng I = 1,93A. Giá trị của t trên đồ thị là
Câu 10: Thực hiện phản ứng nhiệt nhôm hỗn hợp gồm Al và m gam hai oxit sắt trong khí trơ, thu được hỗn hợp rắn X. Cho X vào dung dịch NaOH dư, thu được dung dịch Y, chất không tan Z và 0,672 lít khí H2. Sục khí CO2 dư vào Y, thu được 46,8 gam kết tủa. Cho Z tan hết vào dung dịch HNO3 , thu được dung dịch chứa 146,52 gam muối nitrat và 12,992 lít NO (là sản phẩm khử duy nhất của HNO3). Biết các phản ứng xảy ra hoàn toàn, các thể tích khí đo ở điều kiện tiêu chuẩn. Giá trị của m là
Câu 11: Hòa tan hết 17,92 gam hỗn hợp X gồm Fe3O4 , FeO, Fe, CuO, Cu , Al và Al2O3 ( trong đó oxi chiếm 25,446% về khối lượng ) vào dung dịch HNO3 loãng dư, kết thúc các phản ứng thu được dung dịch Y và 1,736 lít (đktc) hỗn hợp khí Z gồm N2 và N2O, tỉ khối Z so với H2 là 15,29. Cho dung dịch NaOH tới dư vào Y rồi đun nóng , không có khí thoát ra. Số mol HNO3 đã phản ứng có giá trị gần nhất với
Câu 12: Xà phòng hoá hoàn toàn m gam chất béo trung tính bằng dung dịch KOH dư thì thu được 18,77 gam xà phòng. Nếu thay dung dịch KOH bằng dung dịch NaOH dư thì chỉ thu được 17,81 gam xà phòng. Giá trị của m là
Câu 13: Đốt cháy hoàn toản 0,1 mol anđehit đơn chức X cần dùng vừa đủ 12,32 lít khí O2 (đktc), thu được 17,6 gam CO2, X là anđehit nào dưới đây?
Câu 14: Hòa tan hoàn toàn 20g hỗn hợp A gồm Mg và Fe2O3 bằng dung dịch HNO3 đặc dư thu được dung dịch B và V lít khí NO2 (đktc) là sản phẩm khử duy nhất. Thêm NaOH dư vào dung dịch B. Kết thúc thí nghiệm, lọc lấy kết tủa đem nung trong không khí đến khối lượng không đổi thu được 28g chất rắn. Giá trị của V là:
Câu 15: Dung dịch X có chứa AgNO3 và Cu(NO3)2 có cùng nồng độ mol. Thêm 1 hỗn hợp gồm 0,03 mol Al và 0,05 mol Fe vào 100 ml dung dịch X cho tới khi phản ứng kết thúc thu được chất rắn Y gồm 3 kim loại. Cho m gam Y vào HCl dư giải phóng 0,07g khí. Nồng độ của 2 muối ban đầu là:
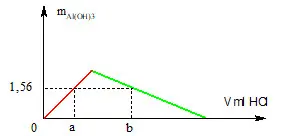
Câu 16: Rót từ từ dung dịch HCl 0,1M vào 200 ml dung dịch KAlO2 0,2M. Khối lượng kết tủa thu được phụ thuộc vào V (ml) dung dịch HCl như hình bên dưới. Giá trị của a và b lần lượt là:
Câu 17: Đốt cháy hoàn toàn một lượng chất hữu cơ X thu được 3,36 lít khí CO2, 0,56 lít khí N2 (các khí đo ở đktc) và 3,15 gam H2O. Khi X tác dụng với dung dịch NaOH thu được sản phẩm có muối H2N – CH2 – COONa. Công thức cấu tạo thu gọn của X là
Câu 18: Hợp chất khí với hiđro của nguyên tố R có dạng RH4. Oxit cao nhất của R chứa 53,3% khối lượng oxi. Công thức oxit cao nhất là:
Câu 19: Hỗn hợp khí A gồm Cl2 và O2. Cho A phản ứng vừa hết với 1 hỗn hợp gồm 4,8 gam Mg và 8,1 gam Al thu được 37,05 gam hỗn hợp các muối clorua và các oxit của 2 kim loại. Thành phần % theo khối lượng của các khí trong A là?
Câu 20: Hỗn hợp khí X gồm etilen và propin. Cho a mol X tác dụng với lượng dư dung dịch AgNO3 trong NH3, thu được 17,64 gam kết tủa. Mặt khác a mol X phản ứng tối đa với 0,34 mol H2. Giá trị của a là:
Câu 21: Cho 2,4 gam hỗn hợp C2H2, C3H8, C2H6, C4H6 và H2 đi qua bột Ni nung nóng, sau một thời gian thu được hỗn hợp khí X. Đốt cháy hoàn toàn X cần vừa đủ V lít khí O2 (đktc), thu được 3,36 lít CO2 (đktc). Gía trị của V là
Câu 22: Hòa tan hết 3,24 gam bột Al trong dung dịch HNO3 dư, thu được 0,02 mol khí X duy nhất và dung dịch Y chứa 27,56 gam muối. Khí X là
Câu 23: Hỗn hợp X gồm một este, một axit cacboxylic và một ancol (đều no, đơn chức, mạch hở). Thủy phân hoàn toàn 6,18 gam X bằng lượng vừa đủ dung dịch chứa 0,1 mol NaOH thu được 3,2 gam một ancol. Cô cạn dung dịch sau thủy phân rồi đem lượng muối khan thu được đốt cháy hoàn toàn thu được 0,05 mol H2O. Phần trăm khối lượng của este có trong X là
Câu 24: Hỗn hợp X gồm glyxin, alanin, valin, metylamin và etylamin. Đốt cháy hoàn toàn 0,16 mol hỗn hợp X cần dùng vừa đủ 0,57 mol O2. Sản phẩm cháy gồm CO2, H2O và N2 (trong đó số mol CO2 là 0,37 mol). Cho lượng X trên vào dung dịch KOH dư thấy có a mol KOH tham gia phản ứng. Giá trị của a là
Câu 25: Hòa tan hoàn toàn 3,60 gam Mg trong 500 ml dung dịch HNO3 0,80M, phản ứng kết thúc thu được 448 ml một khí X (ở đktc) và dung dịch Y có khối lượng lớn hơn khối lượng dung dịch HNO3 ban đầu là 3,04 gam. Để phản ứng hết với các chất trong Y cần vừa đủ V ml dung dịch NaOH 2,00M. Giá trị của V là
Câu 26: Hòa tan 11,6 gam hỗn hợp A gồm Fe và Cu vào 87,5 gam dung dịch HNO3 50,4%, sau khi kim loại tan hết thu được dung dịch X và V lít (đktc) hỗn hợp khí B ( gồm hai chất khí có tỉ lệ số mol 3:2). Cho 500 ml dung dịch KOH 1M vào dung dịch X thu được kết tủa Y và dung dịch Z. Lọc lấy Y rồi nung trong không khí đến khối lượng không đổi thu được 16,0 gam chất rắn. Cô cạn dung dịch Z được chất rắn T. Nung T đến khối lượng không đổi thu được 41,05 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Nồng độ % của Fe(NO3)3 trong X là:
Câu 27: Hòa tan Fe trong dung dịch HNO3 dư thấy sinh ra hỗn hợp khí chứa 0,03 mol NO2 và 0,02mol NO duy nhất.Khối lượng Fe bị hòa tan là:
Câu 28: Khử hoàn toàn 32 gam CuO thành kim loại cần vừa đủ V lít khí CO (đktc). Giá trị của V là
Câu 29: Xà phòng hóa hoàn toàn m gam tristearin bằng dung dịch KOH vừa đủ, thu được 115,92 gam muối. Giá trị của m là
Câu 30: Chất nào sau đây thuộc loại chất điện li mạnh?
Câu 31: Hấp thụ hoàn toàn 3,36 lít khí CO2 (đktc) vào dung dịch chứa 0,15 mol NaOH và 0,1 mol Ba(OH)2, thu được m gam kết tủa. Giá trị của m là:
Câu 32: Đun nóng 0,2 mol este đơn chức X với 135 ml dung dịch NaOH 2M. Sau phản ứng xảy ra hoàn toàn, cô cạn dung dịch thu được ancol etylic và 19,2 gam chất rắn khan. Công thức cấu tạo của X là?
Câu 33: Có bao nhiêu chất chứa vòng benzen có cùng công thức phân tử C7H8O?
Câu 34: Cho 12,55 gam CH3CH(NH3Cl)COOH tác dụng với 150 ml dung dịch Ba(OH)21M. Cô cạn dung dịch sau phản ứng, thu được m gam chất rắn. Giá trị của m là
Câu 35: Dãy nào sau đây chỉ gồm các chất vừa tác dụng được với dung dịch HCl, vừa tác dụng được với dung dịch AgNO3 ?
Câu 36: Cho 6,03 gam hỗn hợp saccarozơ và glucozơ tác dụng với lượng dư dung dịch AgNO3/NH3, sau khi phản ứng xảy ra hoàn toàn thu được 1,08 gam Ag. Số mol saccarozơ và glucozơ trong hỗn hợp lần lượt là
Câu 37: Đốt cháy hỗn hợp kim loại gồm 1,92 g Mg và 4,48 g Fe với hỗn hợp khí X gồm clo và oxi, sau phản ứng chỉ thu được hỗn hợp Y gồm các oxit và muối clorua(không còn khí dư). Hoà tan Y bằng một lượng vừa đủ 120ml dung dịch HCl 2M thu được dung dịch Z. Cho AgNO3 dư vào dung dịch Z sau phản ứng hoàn toàn thu được 56,69 g kết tủa. Phần trăm theo thể tích khí clo trong hỗn hợp X:
Câu 38: Hỗn hợp X gồm hai chất hữu cơ no, mạch hở (đều chứa C, H, O), trong phân tử mỗi chất có hai nhóm chức trong số các nhóm –OH, –CHO, –COOH. Cho m gam X phản ứng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3, thu được 4,05 gam Ag và 1,86 gam muối amoni hữu cơ. Cho toàn bộ lượng muối amoni hữu cơ vào dung dịch NaOH (dư, đun nóng), thu được 0,02 mol NH3. Giá trị của m là
Câu 39: Cho ba kim loại Al, Fe, Cu vào 2 lít dung dịch HNO3 phản ứng vừa đủ thu được 1,792 lít khí X ở(đktc) gồm N2 và NO2 có tỉ khối so với He bằng 9,25. Nồng độ mol HNO3 trong dung dịch đầu:
Câu 40: Hỗn hợp X gồm glyxin; axit glutamic và axit metacrylic. Hỗn hợp Y gồm etilen và đimetylamin. Đốt cháy a mol X và b mol Y thì tổng số mol khí oxi cần dùng vừa đủ là 2,625 mol, thu được H2O; 0,2 mol N2 và 2,05 mol CO2. Mặt khác, khi cho a mol X tác dụng với dung dịch NaOH dư thì lượng NaOH phản ứng là m gam. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là: