Đề thi thử THPT QG năm 2022 môn Hóa học online – Đề thi của Trường THPT Bắc Trà giúp bạn đánh giá chính xác mức độ hiểu bài thông qua nội dung bám sát chương trình học. Các câu hỏi được thiết kế khoa học giúp bạn học mà không cảm thấy áp lực. Đặc biệt phù hợp với học sinh muốn cải thiện điểm số. Thông qua quá trình làm bài, bạn có thể xác định phần kiến thức còn yếu. Điều này giúp việc học trở nên có mục tiêu rõ ràng hơn.
Đề thi thử THPT QG năm 2022 môn Hóa học online – Đề thi của Trường THPT Bắc Trà
Câu 1: Một trong các yếu tố quyết định chất lượng của phích nước là độ phản quang cao của lớp Ag giữa hai lớp thủy tinh của bình. Trong công nghiệp sản xuất phích, để trang bạc người ta đã sử dụng phản ứng của AgNO3/NH3 với
Câu 2: Phân đạm cung cấp cho cây trồng nguyên tố nào?
Câu 3: Trường hợp nào sau đây xảy ra ăn mòn điện hóa
Câu 4: Tiến hành phản ứng trùng hợp 5,2 gam stiren. Thêm 400 ml dung dịch Br2 0,125M vào hỗn hợp sau phản ứng, khuấy đều để phản ứng hoàn toàn thì còn dư 0,04 mol Br2. Khối lượng polime sinh ra là
Câu 5: Một loại nước chứa các ion Na+, Ba2+, Ca2+, Mg2+, Pb2+, H+, Cl-. Muốn tách được nhiều cation ra khỏi dung dịch mà không đưa ion lạ vào nước thì phải dùng vừa đủ dung dịch
Câu 6: Cho sơ đồ phản ứng (a) X + H2O $\xrightarrow{{xuc\,tac}}$ Y (b) Y + AgNO3 + NH3 + H2O → Amoni gluconat + Ag + NH4NO3. (c) Y $\xrightarrow{{xuc\,tac}}$ E + Z (d) Z + H2O $\xrightarrow[{diep\,luc}]{{anh\,sang}}$ X + G X, Y, Z lần lượt là
Câu 7: Thủy phân este X mạch hở có công thức phân tử C4H6O2 thì dung dịch thu được có khả năng tráng bạc. Số este thỏa mãn tính chất trên là
Câu 8: Cho các phát biểu sau (a) Chất béo là trieste của glixerol và axit béo. (b) Chất béo nhẹ hơn nước và không tan trong nước. (c) Glucozơ thuộc loại monosaccarit. (d) Các este bị thủy phân trong môi trường kiềm đều tạo muối và ancol. (e) Tất cả các peptit đều có phản ứng với Cu(OH)2 tạo hợp chất màu tím. (g) Dung dịch saccarozơ không tham gia phản ứng tráng bạc. Số phát biểu đúng là
Câu 9: Số đồng phân cấu tạo của C2H7N là
Câu 10: Cho các kim loại sau: Cu, Al, Ag, Fe. Kim loại dẫn điện tốt nhất là
Câu 11: Hòa tan vừa hết 3,61 gam hỗn hợp A gồm Fe và kim loại M (hóa trị không đổi) bằng dung dịch HCl thì thu được 2,128 lít H2 (đktc). Nếu hòa tan A bằng dung dịch H2SO4 đặc nóng thì thu được 2,688 lít SO2 (đktc). Kim loại M là
Câu 12: Cho 5,2 gam kim loại M tác dụng vừa đủ với dung dịch HNO3 thì thu được 1,008 lít (đktc) hỗn hợp khí X gồm N2O và NO và X có khối lượng 1,42 gam. Kim loại M là
Câu 13: Cho 0,42 gam hỗn hợp Fe và Al vào 250 ml dung dịch AgNO3 0,12M. Sau khi các phản ứng xảy ra hoàn toàn thu được 3,333 gam chất rắn. Khối lượng Fe ban đầu là
Câu 14: Thủy phân este Z trong môi trường axit thu được hai chất hữu cơ X và Y (MX < MY). Bằng một phản ứng có thể chuyển hoá X thành Y. Chất Z không thể là
Câu 15: Cho X là axit có công thức dạng CnH2nO2, Y là este mạch hở dạng CmH2m-4O4. Đốt cháy hoàn toàn hỗn hợp E gồm 0,6 mol X và 0,15 mol Y thì thu được CO2 và H2O có tổng khối lượng là 87,6 gam. Nếu đun nóng E với dung dịch NaOH thu được hỗn hợp 2 muối và 9,3 gam một ancol. Công thức cấu tạo của Y là
Câu 16: Xà phòng hóa 2,76 gam một este X bằng dung dịch NaOH vừa đủ, thu được 4,44 gam hỗn hợp hai muối natri. Nung nóng 2 muối này trong oxi dư, thu được 3,18 gam Na2CO3, 2,464 lít CO2 (đktc) và 0,9 gam H2O. X có CTPT trùng với CTĐGN. Cấu tạo của X là
Câu 17: Cho từ từ dung dịch chứa a mol Ba(OH)2 vào dung dịch chứa b mol ZnSO4. Đồ thị biểu diễn số mol kết tủa theo giá trị của a như sau: Giá trị của b + x là:
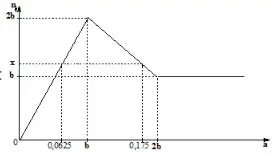
Câu 18: Cho 9,16 gam hỗn hợp X gồm Zn, Fe, Cu vào 170 ml dung dịch CuSO4 1M để phản ứng hoàn toàn, thu được dung dịch Y và chất rắn Z. Nung Z trong không khí đến khối lượng không đổi, thu được 12 gam chất rắn T. Cho Y tác dụng với dung dịch NaOH dư, lọc lấy kết tủa nung trong không khí đến khối lượng không đổi, thu được 10,4 gam chất rắn E. Phần trăm khối lượng Zn trong X là?
Câu 19: Nicotine là chất hữu cơ có trong thuốc lá, gây nghiện và là mầm mống của bệnh ung thư. Hợp chất này được tạo thành bởi 3 nguyên tố C, H, N. Đốt cháy hết 2,349 gam nicotine thu được N2, 1,827 gam H2O và 3,248 lít CO2 (đktc). Công thức đơn giản nhất của nicotine là
Câu 20: Xenlulozơ trinitrat được điều chế từ xenlulozơ và axit nitric đặc có xúc tác axit sunfuric đặc, nóng. Để có 29,7 kg xenlulozơ trinitrat, cần dùng dung dịch chứa m kg axit nitric (hiệu suất phản ứng đạt 90%). Giá trị của m là
Câu 21: Cao su buna-N được tạo ra do phản ứng đồng trùng hợp giữa buta-1,3-đien với acrilonitrin. Đốt cháy hoàn toàn một lượng cao su buna-N với không khí vừa đủ (chứa 80% N2 và 20% O2), sau đó đưa hỗn hợp sau phản ứng về 136,5 độ C thu được hỗn hợp khí và hơi Y (chứa 14,41 % CO2 về thể tích). Tỉ lệ mắt xích giữa buta-1,3-đien và acrilonitrin là
Câu 22: Cho 3,36 gam Mg tác dụng vừa đủ với 200 ml dung dịch hỗn hợp gồm HNO3 0,3M và H2SO4 thu được dung dịch A (chỉ chứa các muối) và 0,02 mol hỗn hợp khí B gồm 2 khí N2O và N2. Tỉ khối của B so với H2 bằng 18. Làm bay hơi nước trong dung dịch A, thu được m gam muối khan. Giá trị m là?
Câu 23: Hỗn hợp X gồm chất Y (C2H10O3N2) và chất Z (C2H7O2N). Cho 14,85 gam X phản ứng vừa đủ với dung dịch NaOH và đun nóng, thu được dung dịch M và 5,6 lít (đktc) hỗn hợp T gồm hai khí đều làm xanh quỳ ẩm. Cô cạn toàn bộ dung dịch M thu được m gam muối khan. Giá trị của m gần nhất với
Câu 24: Cho 15,6 gam hỗn hợp gồm MgO, CuO, Fe3O4, Cu, Fe phản ứng với 200 gam dung dịch hỗn hợp gồm NaNO3 và H2SO4, thu được dung dịch X chỉ chứa các muối sunfat của kim loại, đồng thời thoát ra 0,02 mol NO và 0,1 mol NO2. Cho X phản ứng với dung dịch Ba(OH)2 vừa đủ thu được 98,63 gam kết tủa. Nung kết tủa trong không khí đến khối lượng không đổi thu được 93,93 gam chất rắn. Nồng độ phần trăm của muối FeSO4 trong X gần nhất với giá trị nào sau đây?
Câu 25: Cho X, Y là hai axit cacboxylic đều mạch hở; Z là ancol no; T là este hai chức, mạch hở được tạo bởi X, Y, Z. Đun nóng 38,86 gam hỗn hợp E chứa X, Y, Z, T với 400 ml dung dịch NaOH 1M vừa đủ thu được ancol Z và hỗn hợp F gồm hai muối có tỉ lệ mol 1 : 1. Dẫn toàn bộ Z qua bình đựng Na dư thấy khối lượng bình tăng 19,24 gam; đồng thời thu được 5,824 lít khí H2 (đktc). Đốt cháy hoàn toàn F cần dùng 0,7 mol O2 thì được CO2, Na2CO3 và 0,4 mol H2O. Phần trăm khối lượng của T trong E gần nhất với giá trị
Câu 26: Điện phân dung dịch chứa AgNO3 với điện cực trơ trong thời gian t (s), cường độ dòng điện 2A thu được dung dịch X. Cho m gam bột Mg vào dung dịch X, sau khi phản ứng xảy ra hoàn toàn thu được 0,336 gam hỗn hợp kim loại, 0,112 lít hỗn hợp khí Z (đktc) gồm NO và N2O có tỉ khối so với H2 là 19,2 và dung dịch Y chứa 3,04 gam muối. Cho toàn bộ hỗn hợp kim loại trên tác dụng với dung dịch HCl dư thu được 0,112 lít khí H2 (đktc). Giá trị của t là
Câu 27: Cho X là hỗn hợp gồm HOOC-COOH, OHC-COOH, OHC-C≡C-CHO, OHC-C≡C-COOH; Y là axit cacboxylic no đơn chức, mạch hở. Đun nóng m gam X với lượng dư dung dịch AgNO3/NH3 thu được 23,76 gam Ag. Nếu cho m gam X tác dụng với NaHCO3 dư thì thu được 0,07 mol CO2. Đốt cháy hoàn toàn hỗn hợp gồm m gam X và m gam Y cần 0,805 mol O2 thu được 0,785 mol CO2. Giá trị của m là:
Câu 28: Etylpropionat là este có mùi thơm của dứa. Công thức của etyl propionat là
Câu 29: Chất có phản ứng màu với biure là
Câu 30: Trong thực tế, không sử dụng cách nào sau đây để bảo vệ kim loại không bị ăn mòn?
Câu 31: Cho các kim loại sau: Al, Cu, Au Ag. Kim loại dẫn điện tốt nhất trong các kim loại này là
Câu 32: Trong công nghiệp Mg được điều chế bằng cách nào dưới đây?
Câu 33: Kim loại nào sau đây có độ cứng cao nhất ?
Câu 34: Cho 100 ml dung dịch aminoaxit X nồng độ 0,4M tác dụng vừa đủ với 80 ml dung dịch NaOH 0,5M, thu được dung dịch chứa 5 gam muối. Công thức của X là
Câu 35: Cho các tơ sau: tơ xenlulozo axetat, tơ capron, tơ nitron, tơ visco, tơ nilin -6,6. Có bao nhiêu tơ thuộc loại tơ poliamit?
Câu 36: Điện phân (điện cực trơ) dung dịch X chứa 0,2 mol CuSO4 và 0,12 mol NaCl bằng dòng điện có cường độ 2A. Thể tích khí (đktc) thoát ra ở anot sau 9650 giây điện phân là
Câu 37: Cho các cặp oxi hóa – khử được sắp xếp theo chiều tăng dần tính oxi hóa của dạng oxi hóa như sau: Fe2+/Fe, Cu2+/Cu, Fe3+/Fe2+. Phát biểu nào sau đây đúng?
Câu 38: Dung dịch X gồm 0,02 mol Cu(NO3)2 và 0,1 mol H2SO4. Khối lượng Fe tối đa phản ứng với dung dịch X là (biết NO là sản phẩm khử duy nhất của NO3‑)
Câu 39: Có bao nhiêu tripeptit mạch hở khác loại khi thủy phân hoàn toàn thu được 3 aminoaxit: glyxin, alanin và valin?
Câu 40: Cho 2,0 gam hỗn hợp X gồm metylamin, đi metylamin phản ứng vừa đủ với 0,05 mol HCl, thu được m gam muối. Giá trị của m là