Thi Thử Tốt Nghiệp THPT Hóa học năm 2025 – THPT Chuyên Bắc Ninh giúp bạn nhận biết điểm mạnh và điểm yếu của bản thân thông qua dạng bài tập quen thuộc thường gặp trong đề thi. Các câu hỏi được xây dựng theo lộ trình giúp bạn tự tin hoàn thành bài quiz. Đặc biệt phù hợp với người học muốn tự đánh giá năng lực. Thông qua quá trình làm bài, bạn có thể điều chỉnh phương pháp học tập cho phù hợp. Điều này giúp việc học trở nên tiết kiệm thời gian hơn.
Thi Thử Tốt Nghiệp THPT Hóa học năm 2025 – THPT Chuyên Bắc Ninh
Câu 1: Cho các dung dịch có cùng nồng độ: Na₂CO₃ (1), H₂SO₄ (2), HCL(3), KNO₃ (4) Giá trị pH của các dung dịch được sắp xếp theo chiều tăng dần từ trái sang phải là
Câu 2: So với các acid, alcohol có cùng số nguyên tử carbon thì ester có nhiệt độ sôi
Câu 3: Phú dưỡng là hệ quả sau khi ao ngòi, sông hồ nhận quá nhiều các nguồn thải chứa các chất dinh dưỡng chứa nguyên tố nào sau đây?
Câu 4: Phát biểu nào sau đây đúng?
Câu 5: Dãy chất nào sau đây đều là chất điện li yếu?
Câu 6: Phát biểu nào sau đây là đúng?
Câu 7: Trong khí thải do đốt nhiên liệu hóa thạch có chất khí X không màu, mùi hắc, gây viêm đường hô hấp ở người. Khi khuếch tán vào bầu khí quyển, X là nguyên nhân chủ yếu gây hiện tượng “mưa acid’. X là
Câu 8: Cho các phát biểu sau: (1) Dung dịch ethylamine và dung dịch aniline đều làm xanh giấy quỳ tím. (2) Nhỏ từ từ đến dư dung dịch methylamine vào dung dịch copper(II) sulfate, ban đầu thấy xuất hiện kết tủa màu xanh nhạt, sau đó kết tủa tan tạo thành dung dịch màu xanh lam. (3) Cho dung dịch methylamine vào ống nghiệm đựng dung dịch iron(III) chloride thấy xuất hiện kết tủa nâu đỏ. (4) Nhỏ vài giọt dung dịch aniline vào ống nghiệm đựng nước bromine thấy xuất hiện kết tủa trắng. Số phát biểu đúng là
Câu 9: Cho cân bằng sau trong bình kín: 2NO₂ (g) (MÀU NÂU ĐỎ) ⇌ N₂O₄ (g) (KHÔNG MÀU). Biết khi hạ nhiệt độ của bình thì màu nâu đỏ nhạt dần. Phản ứng thuận có
Câu 10: Chất X có công thức phân tử C6H8O4. Từ X thực hiện các phản ứng sau (theo đúng tỉ lệ): Phát biểu nào sau đây đúng ?
Câu 11: Chất nào sau đây không dẫn điện được?
Câu 12: Phản ứng với chất nào sau đây chứng tỏ glucose có nhóm -OH hemiacetal?
Câu 13: Một dung dịch gồm: $0,01$ mol $\text{Na}^+$; $0,02$ mol $\text{Ca}^{2+}$; $0,02$ mol $\text{HCO}_3^-$ và $a$ mol ion X (bỏ qua sự điện li của nước). Ion X và giá trị của $a$ có thể là:
Câu 14: Cho các phát biểu sau: 1) Glucose và fructose không tham gia phản ứng thủy phân. 2) Có thể phân biệt glucose và fructose bằng nước bromine. $Cn(H2O)_m.$ 4) Chất béo không phải là carbohydrate.Số phát biểu đúng là
Câu 15: Trên bao bì của một loại phân bón hỗn hợp NPK có ghi số 16 - 16 - 8. Trong 50,0 kg phân bón trên có chứa khối lượng của các nguyên tố N, P, K lần lượt là (kết quả làm tròn đến chữ số thập phân thứ 2)
Câu 16: Chất giặt rửa tổng hợp được sản xuất từ nguồn nguyên liệu nào sau đây?
Câu 17: Trong bình dung tích không đổi chứa hỗn hợp khí X gồm H₂ và N₂ (chất xúc tác thích hợp), áp suất trong bình là p atm, tỉ khối của X so với H₂ là 3,6. Nung nóng bình để thực hiện phản ứng tổng hợp NH₃ rồi làm nguội bình về nhiệt độ ban đầu, thu được hỗn hợp khí Y, áp suất trong bình là 0,9p atm. Hiệu suất phản ứng tổng hợp NH₃ là
Câu 18: Hỗn hợp X gồm hai ester có cùng công thức phân tử C₄H₈O₂ và đều chứa vòng benzene. Để phản ứng hết với 0,25 mol X cần tối đa 0,35 mol NaOH trong dung dịch, thu được m gam hỗn hợp hai muối. Giá trị của m là bao nhiêu?
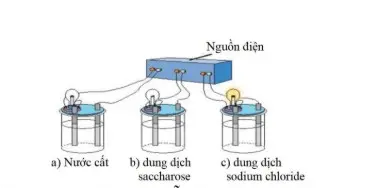
Câu 19: Tiến hành thí nghiệm như hình vẽ, chỉ thấy bóng đèn ở cốc (c) sáng:
Câu 20: Cho các cân bằng hóa học sau: Chọn phát biểu đúng sai trong mỗi phát biểu sau:
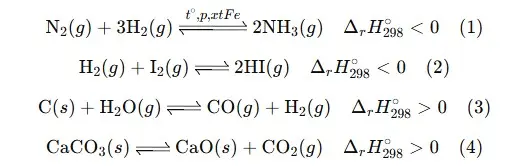
Câu 21: Câu 3. Alanine phản ứng với ethyl alcohol khi có mặt HCl khan theo sơ đồ sau: Ala+C2 H5 OH+HCl⟶X+H2 O
Câu 22: Thủy phân một tripeptide X thu được 3 amino acid là Ala, Gly và Val.
Câu 23: Vỏ trứng có chứa calcium ở dạng calcium carbonate $CaCO_3$ Để xác định hàm lượng $CaCO_3$ trong vỏ trứng, trong phòng thí nghiệm người ta có thể làm như sau: Lấy 1,0 g vỏ trứng khô, đã được làm sạch, hoà tan hoàn toàn trong 50 mL dung dịch HCl 0,4 M. Lọc dung dịch sau phản ứng thu được 50 mL dung dịch A. Lấy 10,0 mL dung dịch A chuẩn độ với dung dịch NaOH 0,1 M thấy hết 5,6 mL. Giả thiết các tạp chất khác trong vỏ trứng không phản ứng với HCl, xác định hàm lượng (%) calcium trong vỏ trứng? (kết quả làm tròn đến hàng phần mười)
Câu 24: Một nhà máy luyện kim sản xuất zinc (Zn) từ 60 tấn quặng blend (chứa 80% ZnS về khối lượng, còn lại là tạp chất không chứa zinc) với hiệu suất cả quá trình đạt 97%. Phương trình phản ứng sản xuất như sau: Toàn bộ lượng Zn tạo ra được đúc thành nnn thanh Zn hình hộp chữ nhật: Chiều dài 120 cm, chiều rộng 30 cm và chiều cao 10 cm. Biết khối lượng riêng của kẽm là 7,14 g/cm³, hãy xác định giá trị của nnn. (Kết quả làm tròn đến hàng đơn vị)
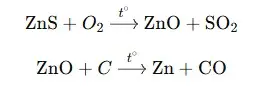
Câu 25: Cho phản ứng: CO(g) + Cl2(g) ⇌ COCl2(g) được thực hiện trong bình kín dung tích 1 lít ở nhiệt độ không đổi. Khi phản ứng đạt trạng thái cân bằng, nồng độ của các chất là: [CO] = 0,2M; [Cl₂] = 0,1M; [COCl₂] = 0,2M. Nếu bơm thêm vào bình 14,2 gam Cl₂ thì nồng độ mol/L của CO ở trạng thái cân bằng mới là bao nhiêu? (kết quả làm tròn đến hàng phần trăm)
Câu 26: Một mẫu cồn X (thành phần chính là ethanol) có lẫn methanol. Khi được đốt cháy hoàn toàn, 1 molethanol tỏa ra lượng nhiệt là 1370 kJ và 1 mol methanol tỏa ra lượng nhiệt là 716 kJ. Đốt cháy hoàn toàn ethanol tỏa ra lượng nhiệt là 1370 kJ và 1 mol methanol tỏa ra lượng nhiệt là 716 kJ. Đốt cháy hoàn toàn 10 gam mẫu cồn X tỏa ra một nhiệt lượng là 291,9 kJ. Xác định thành phần phần trăm về khối lượng của tạp chất methanol trong mẫu cồn X. (kết quả làm tròn đến hàng đơn vị)
Câu 27: Đốt cháy hoàn toàn hỗn hợp E gồm alcohol X (Cx Hy O) và amine Y (no, mạch hở, hai chức) cần vừa đủ 26,88 lít $ \text{O}_2 $ , thu được $ \text{N}_2 $ , $ \text{H}_2\text{O} $ và 13,44 lít CO2. Biết, nếu đốt cháy hoàn toàn 0,2 mol X trong bình kín chứa 22,4 lít $ \text{O}_2 $ (dư), sau phản ứng trong bình thu được 1,5 mol khí và hơi. Các khí đều được đo ở điều kiện tiêu chuẩn. Phần trăm khối lượng Y trong E là bao nhiêu? (kết quả làm tròn đến hàng phần mười)
Câu 28: Một ruột phích có diện tích bề mặt là 0,35 $ m_2 $ Để tráng được 2000 ruột phích như trên với độ dày lớp bạc là 0,1 mthì cần dùng m kg glucose 10% tác dụng với lượng dư dung dịch AgNO3 trong NH3. Biết hiệu suất phản ứng tráng bạc là 75% và khối lượng riêng của silver là $ 10,49 \, \text{g/cm}^3 $. Giá trị của m là bao Giá trị của m là baonhiêu? (kết quả làm tròn đến hàng phần trăm).