Đề thi thử THPT QG năm 2022 môn Hóa học online – Đề thi của Trường THPT Hương Sơn giúp bạn đánh giá chính xác mức độ hiểu bài thông qua nội dung bám sát chương trình học. Các câu hỏi được thiết kế khoa học giúp bạn học mà không cảm thấy áp lực. Đặc biệt phù hợp với học sinh muốn cải thiện điểm số. Thông qua quá trình làm bài, bạn có thể xác định phần kiến thức còn yếu. Điều này giúp việc học trở nên có mục tiêu rõ ràng hơn.
Đề thi thử THPT QG năm 2022 môn Hóa học online – Đề thi của Trường THPT Hương Sơn
Câu 1: Cho các thí nghiệm sau: (a) Thêm vài giọt dung dịch HNO3 vào ống nghiệm chứa dung dịch Fe(NO3)2. (b) Thêm vào ml dung dịch NaOH vào dung dịch HCl. (c) Dẫn khí H2S vào dung dịch FeCl3. (d) Dẫn khí CO2 dư vào dung dịch NaOH. Số thí nghiệm xảy ra phản ứng oxi hóa - khử là:
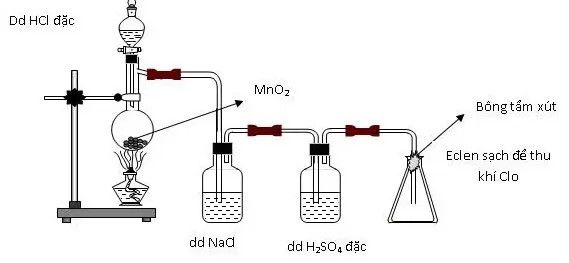
Câu 2: Thực hiện thí nghiệm điều chế clo theo sơ đồ sau: Cho các nhận định sau: (a) Bình chứa dung dịch NaCl dùng để giữ khí HCl. (b) Bình chứa dung dịch H2SO4 đặc để giữ hơi nước. (c) Bông tẩm dung dịch xút có thể thay bằng tẩm nước. (d) Có thể thay chất rắn trong bình cầu thành thuốc tím. Số nhận định chính xác là:
Câu 3: Số oxi hóa của sắt trong hợp chất FeO và Fe(NO3)3 lần lượt là:
Câu 4: Nghiền nhỏ 1 gam C2H5COONa cùng với 2 gam vôi tôi xút (CaO và NaOH) rồi cho vào đáy ống nghiệm. Đun nóng đều ống nghiệm, sau đó đun tập trung phần có chứa hỗn hợp phản ứng. Hiđrocacbon sinh ra trong thí nghiệm trên thuộc dãy đồng đẳng
Câu 5: Đốt cháy hoàn toàn 6,46 gam hỗn hợp E gồm ba este no, mạch hở X, Y, Z (đều tạo bởi axit cacboxylic và ancol; MX < MY< MZ < 248) cần vừa đủ 0,235 mol O2, thu được 5,376 lít khí CO2. Cho 6,46 gam E tác dụng hết với dung dịch NaOH (lấy dư 20% so với lượng phản ứng) rồi chưng cất dung dịch, thu được hỗn hợp hai ancol đồng đẳng kế tiếp và hỗn hợp chất rắn khan T. Đốt cháy hoàn toàn T, thu được Na2CO3, CO2 và 0,18 gam H2O. Phân tử khối của Z là
Câu 6: Hỗn hợp X gồm ba este mạch hở đều tạo bởi axit cacboxylic với ancol no, trong đó có hai este đơn chức và một este hai chức. Đốt cháy hoàn toàn 3,82 gam X trong O2, thu được H2O và 0,16 mol CO2. Mặt khác, cho 3,82 gam X phản ứng vừa đủ với dung dịch NaOH, thu được hỗn hợp Y gồm hai ancol đồng đẳng kế tiếp và dung dịch chứa 3,38 gam hỗn hợp muối. Đun nóng toàn bộ Y với H2SO4 đặc, thu đưọc tối đa 1,99 gam hỗn hợp ba ete. Phần trăm khối lượng của este có phân tử khối nhỏ nhất trong X là
Câu 7: Tiến hành thí nghiệm xà phòng hóa chất béo: Bước 1: Cho vào bát sứ nhỏ khoảng 2 ml dầu dừa và 6 ml dung dịch NaOH 40%. Bước 2: Đun sôi nhẹ hỗn hợp, liên tục khuấy đều bằng đũa thủy tinh khoảng 30 phút và thỉnh thoảng thêm nước cất để giữ cho thể tích hỗn hợp không đổi rồi để nguội hỗn hợp. Bước 3: Rót thêm vào hỗn hợp 7 - 10 ml dung dịch NaCl bão hòa nóng, khuấy nhẹ rồi để yên hỗn hợp. Phát biểu nào sau đây đúng?
Câu 8: Điện phân dung dịch X gồm 0,2 mol NaCl và a mol Cu(NO3)2 (với các điện cực trơ, màng ngăn xốp, cường độ dòng điện không thay đổi), thu được dung dịch Y có khối lượng giảm 17,5 gam so với khối lưọng của X. Cho m gam Fe vào Y đến khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Z, khí NO (sản phẩm khử duy nhất của N+5) và (m - 0,5) gam hỗn hợp kim loại. Giả thiết hiệu suất điện phân là 100%, nước bay hơi không đáng kể. Giá trị của a là
Câu 9: Cho các phát biểu sau: (a) Thủy phân hoàn toàn xenlulozơ hay tinh bột đều thu được glucozơ. (b) Thủy phân hoàn toàn các triglixerit luôn thu được glixerol. (c) Tơ poliamit kém bền trong dung dịch axit và dung dịch kiềm. (d) Muối mononatri glutamat được ứng dụng làm mì chính (bột ngọt). (e) Saccarozơ có phản ứng tráng bạc. Số phát biểu đúng là
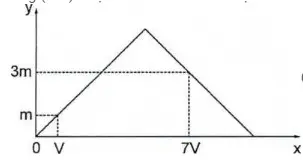
Câu 10: Dẫn từ từ đến dư khí CO2 vào dung dịch chứa 0,01 mol Ca(OH)2. Sự phụ thuộc của khối lượng kết tủa (y gam) vào thể tích khí CO2 tham gia phản ứng (x lít) được biểu diễn như đồ thị: Giá trị của m là
Câu 11: Cho các phát biểu sau: (a) Cho dung dịch NH3 vào dung dịch AlCl3 có xuất hiện kết tủa. (b) Nhiệt phân hoàn toàn Cu(NO3)2 tạo thành Cu. (c) Hỗn hợp Na2O và Al (tỉ lệ mol 1 : 1) tan hết trong nước dư. (d) Trong công nghiệp dược phẩm, NaHCO3 được dùng để điều chế thuốc đau dạ dày. (e) Trong công nghiệp, Al được sản xuất bằng phương pháp điện phân nóng chảy AlCl3. Số phát biểu đúng là
Câu 12: Thủy phân este X có công thức C4H8O2, thu được ancol etylic. Tên gọi của X là
Câu 13: Phản ứng hóa học nào sau đây có phương trình ion rút gọn: H+ + OH-→ H2O?
Câu 14: Cho các nhận định sau (1) Chất béo thuộc loại hợp chất este (2) Chất béo là thành phần chính của dầu mỡ động vật, thực vật (3) Khi đun nóng chất béo lỏng với hidro có xúc tác Ni thì thu được chất béo rắn (4) Chất béo chứa axit không no thường là chất lỏng ở nhiệt độ thường và được gọi là dầu (5) Phản ứng thủy phân chất béo trong môi trường kiềm là phản ứng thuận nghịch Số nhận định đúng là?
Câu 15: Phương trình điện li viết đúng là
Câu 16: Chất nào sau đây thuộc loại đissaccarit:
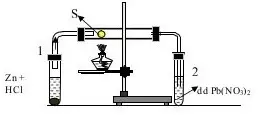
Câu 17: Cho thí nghiệm như hình vẽ sau: Phản ứng xảy ra trong ống nghiệm 2 là
Câu 18: Xà phòng hóa hoàn toàn 0,1 mol este E đơn chức mạch hở bằng 26 gam dung dịch MOH 28% ( M là kim loại kiềm) rồi tiến hành chưng cất sản phẩm thu được 26,12 gam chất lỏng và 12,88 gam chất rắn khan Y. Nung chất rắn Y trong bình kín với lượng oxi vừa đủ, sau khi các phản ứng xảy ran hoàn toàn thu được khí CO2, hơi nước và 8,97 gam một muối duy nhấtCho các phát biểu liên quan tới bài toán: (1) Thể tích khí CO2 thu được là 5,264 lít ở đktc (2) Tổng số nguyên tử C, H, O có trong một phân tử E là 21 (3) Este E tạo bởi ancol có phân tử khối là 74 (4) Este E có khả năng tham gia phản ứng tráng bạc. Trong số các phát biểu trên, số phát biểu đúng là
Câu 19: Thực hiện phản ứng nhiệt nhôm hoàn toàn m gam Fe2O3 và 8,1 gam Al. Chỉ có oxit kim loại bị khử tạo kim loại. Đem hòa tan hỗn hợp các chất thu được sau phản ứng bằng dung dịch NaOH dư thoát ra 3,36 lít khí H2 đktc. Trị số của m là:
Câu 20: Thực hiện phản ứng nhiệt nhôm giữa Al và Cr2O3 trong điều kiện không có không khí. Sau phản ứng hoàn toàn thu được hỗn hợp X có khối lượng 43,9 gam. Chia X thành 2 phần bằng nhau: - Cho phần 1 tác dung với dung dịch NaOH dư thu được 1,68 lít khí đktc - Phần 2 phản ứng vừa đủ với V lít dung dịch HCl 1M loãng nóng Giá trị của V là?
Câu 21: Hãy sắp xếp các cặp oxy hóa – khử sau đây theo thứ tự tăng dần tính oxi hóa của các kim loại: (1) Fe2+/Fe (2) Pb2+/Pb (3) 2H+/H2 (4) Ag+/Ag (5) Na+/Na (6) Fe3+/ Fe2+ (7) Cu2+/Cu
Câu 22: Cho các chất sau: etyl axetat, tripanmitin, saccarozo, etylamin, gly – ala. Số chất tham gia phản ứng thủy phân trong môi trường kiềm là
Câu 23: Cho m gam fructozo tác dụng hết với lượng dư dung dịch AgNO3/NH3 dư, thu được 4,32 gam Ag. Giá trị của m là
Câu 24: Chất nào sau đây không lưỡng tính
Câu 25: Trong số các este sau, este nào có mùi chuối chín:
Câu 26: Có 3 lọ đựng 3 chất bột riêng biệt: Al, Al2O3, Fe. Có thể nhận biết 3 lọ trên bằng 1 thuốc thử duy nhất là
Câu 27: Cho 5,6 g bột Fe vào 200 ml dung dịch AgNO3 1,3M. Sau phản ứng hoàn toàn thu được 200 ml dung dịch có nồng độ mol/l là
Câu 28: Các kim loại phản ứng mạnh với nước ở nhiệt độ thường là
Câu 29: Thủy phân hoàn toàn 17,045 gam hỗn hợp X gồm este Y ( C2H4O2) và este Z (C5H10O2) với dung dịch NaOH vừa đủ thì thu được 0,25 mol ancol Y và m gam muối. giá trị của m là
Câu 30: Đốt cháy hoàn toàn 7,4 gam một amin thu được 6,72 lít khí CO2 đktc và 9 gam H2O. CTPT của amin đó là
Câu 31: Thủy phân m gam saccarozo trong môi trường axit với hiệu suất 90% thu được sản phẩn chứa 10,8 gam glucozo. Giá trị của m là
Câu 32: Thêm 240 ml dung dịch NaOH 1M vào một cốc thủy tinh đựng 100 ml dung dịch AlCl3 nồng đô x M, khuấy đều đến phản ứng hoàn toàn thấy trong cốc có 0,08 mol chất kết tủa. Thêm tiếp 100 ml dung dịch NaOH 1M vào cốc, khuấy đều đến khi phản ứng xảy ra hoàn toàn thấy trong cố có 0,06 mol chất kết tủa. Nồng độ x là
Câu 33: Cho các phát biểu sau (a) Trong một phân tử triolein có 3 liên kết pi (b) Hidro hóa hoàn toàn chất béo lỏng với xúc tác Ni, to, thu được chất béo rắn (c) Xenlulozo trinitrat được dùng làm thuốc sung không khói (d) Poli(metyl metacrylat) được dùng để chế tạo thủy tinh hữu cơ (e) Ở điều kiện thường, etyl amin là chất khí tan nhiều trong nước (g) Thủy phân saccarozo chỉ thu được glucozo Số phát biểu đúng là
Câu 34: Cho 112,5 ml ancol etylic 92o tác dụng với Na dư, đến phản ứng hoàn toàn thu được V lít H2 (đktc). Biết khối lượng riêng của ancol etylic nguyên chất là 0,8 g/ml và của nước là 1 g/ml. Giá trị của V là
Câu 35: Este X được tạo bởi một α aminoaxit có công thức phân tử C5H11O2N, hai chất Y và Z là hai peptit mạch hở, tổng số liên kết peptit trong Y và Z là 7. Đun nóng 63,5 gam hỗn hợp E chứa X, Y, Z với dung dịch NaOH vừa đủ, thu được dung dịch chứa 2 muối ( của glyxin và alanin) và 13,8 gam ancol. Đốt cháy toàn bộ hỗn hợp muối ở trên cần dùng vừa đủ 2,22 mol O2, sau phản ứng thu được Na2CO3 ; CO2; H2O và 7,84 lít N2 đktc. Thành phần phần tram theo khối lượng của peptit có phân tử khối lớn trong hỗn hợp E là:
Câu 36: Cho m gam hỗn hợp X gồm 3 este đều đơn chức tác dụng với tối đa 350 ml dung dịch NaOH 1M, thu được hỗn hợp Y gồm hai ancol cùng dãy đồng đẳng và 28,6 gam hỗn hợp muối Z. Đốt cháy hoàn toàn Y thu được 4,48 lít khí CO2 đktc và 6,3 gam H2O. Giá trị của m là
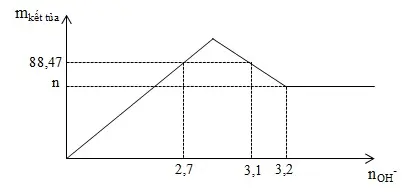
Câu 37: Nhỏ từ từ đến dư dung dịch NaOH vào dung dịch X chứa FeCl3 và AlCl3 thu được đồ thị sau. Giá trị n gần nhất với giá trị nào sau đây?
Câu 38: Một loại nước cứng có chứa các ion: Ca2+, Mg2+ , Cl-, HCO3-; trong đó nồng độ của Cl- là 0,006M và của HCO3- là 0,01M. Hãy cho biết cần lấy bao nhiêu ml dung dịch Na2CO3 0,2M để biến 1 lít nước cứng đó thành nước mềm ? Coi như các chất kết tủa hoàn toàn
Câu 39: Nung 13,6 gam hỗn hợp Mg, Fe trong không khí một thời gian thu được hỗn hợp X gồm các oxit có khối lượng 19,2 gam. Để hòa tan hoàn toàn X cần V ml dung dịch HCl 1M tối thiểu là
Câu 40: Có các phát biểu sau (1) muối phenylamoni clorua không tan trong nước (2) Tất cả các peptit đều có phản ứng màu biure (3) H2N-CH2-CH2-CO-NH-CH2-COOH là một đipeptit (4) Ở điều kiện thường CH5N và C2H7N là những chất khí có mùi khai Số phát biểu đúng là?