Đề thi thử THPT QG năm 2022 môn Hóa học online – Đề thi của Trường THPT Chuyên Hùng Vương giúp bạn nhận biết điểm mạnh và điểm yếu của bản thân thông qua dạng bài tập quen thuộc thường gặp trong đề thi. Các câu hỏi được xây dựng theo lộ trình giúp bạn tự tin hoàn thành bài quiz. Đặc biệt phù hợp với người học muốn tự đánh giá năng lực. Thông qua quá trình làm bài, bạn có thể điều chỉnh phương pháp học tập cho phù hợp. Điều này giúp việc học trở nên tiết kiệm thời gian hơn.
Đề thi thử THPT QG năm 2022 môn Hóa học online – Đề thi của Trường THPT Chuyên Hùng Vương
Câu 1: Tiến hành thí nghiệm theo các bước sau: - Bước 1: Cho vào hai bình cầu mỗi bình 10 ml etyl fomat. - Bước 2: Thêm 10 ml dung dịch H2SO4 20% vào bình thứ nhất, 20 ml dung dịch NaOH 30% vào bình thứ hai. - Bước 3: Lắc đều cả hai bình, lắp ống sinh hàn, đun sôi nhẹ trong 5 phút, sau đó để nguội. Cho các phát biểu sau: (a) Kết thúc bước 2, chất lỏng trong hai bình đều phân thành hai lớp. (b) Ở bước 3, có thể thay việc đun sôi nhẹ bằng đun cách thủy (ngâm trong nước nóng). (c) Ở bước 3, trong bình thứ hai có xảy ra phản ứng xà phòng hóa. (d) Sau bước 3, trong hai bình đều chứa chất có khả năng tham gia phản ứng tráng bạc. Số phát biểu đúng là
Câu 2: Đốt cháy hoàn toàn a gam chất béo X (chứa triglixerit của axit stearic, axit panmitic và các axit béo tự do đó) cần vừa đủ 18,816 lít O2 (đktc). Sau phản ứng thu được 13,44 lít CO2 (đktc) và 10,44 gam nước. Xà phòng hoá a gam X bằng NaOH vừa đủ thì thu được m gam muối. Giá trị của m là
Câu 3: Cho hỗn hợp X gồm 2 este đơn chức (hơn kém nhau 1 nguyên tử C trong phân tử). Đem đốt cháy m gam X cần vừa đủ 0,46 mol O2. Thủy phân m gam X trong 70 ml dung dịch NaOH 1M (vừa đủ) thì thu được 7,06 gam hỗn hợp muối Y và một ancol Z no, đơn chức, mạch hở. Đem đốt hoàn toàn hỗn hợp muối Y thì cần 5,6 lít (đktc) khí O2. Phần trăm khối lượng của este có phân tử khối lớn hơn trong X là?
Câu 4: Kim loại nào sau đây dẫn điện tốt nhất?
Câu 5: Kim loại nào sau đây tác dụng với S ở điều kiện thường?
Câu 6: Kim loại nào sau đây được điều chế bằng phương pháp nhiệt luyện?
Câu 7: Kim loại nào sau đây có thể tan hoàn toàn trong nước ở điều kiện thường?
Câu 8: Ion nào sau đây có tính oxi hóa mạnh nhất?
Câu 9: Kim loại nào sau đây không tác dụng với dung dịch H2SO4 loãng?
Câu 10: Công thức hóa học của nhôm hiđroxit là
Câu 11: Chất có thể làm mềm cả nước có tính cứng tạm thời và nước có tính cứng vĩnh cửu là
Câu 12: Các bể đựng nước vôi trong để lâu ngày thường có một lớp màng cứng rất mỏng trên bề mặt, chạm nhẹ tay vào đó, lớp màng sẽ vỡ ra. Thành phần chính của lớp màng cứng này là
Câu 13: Chất nào sau đây có màu nâu đỏ?
Câu 14: Số oxi hóa của crom trong hợp chất K2Cr2O7 là
Câu 15: Khi làm thí nghiệm với HNO3 đặc, nóng trong ống nghiệm, thường sinh ra khí NO2 rất độc. Để loại bỏ khí NO2 thoát ra gây ô nhiễm môi trường, người ta nút ống nghiệm bằng bông tẩm dung dịch nào sau đây?
Câu 16: Công thức tổng quát của este no, đơn chức, mạch hở là
Câu 17: Etyl axetat bị thuỷ phân trong dung dịch NaOH cho sản phẩm muối nào sau đây?
Câu 18: Chất nào sau đây có cùng phân tử khối với glucozơ?
Câu 19: Ở điều kiện thường chất nào sau đây tồn tại trạng thái khí?
Câu 20: Metylamin (CH3NH2) tác dụng được với chất nào sau đây trong dung dịch?
Câu 21: Polime nào sau đây thuộc loại polime thiên nhiên?
Câu 22: Chất nào sau đây có một liên kết ba trong phân tử
Câu 23: Sản phẩm của phản ứng nhiệt phân hoàn toàn AgNO3 là?
Câu 24: Phản ứng nào sau đây không tạo ra muối sắt(III)?
Câu 25: Este X không no, mạch hở, có tỉ khối hơi so với oxi bằng 3,125 và khi tham gia phản ứng xà phòng hoá tạo ra một anđehit và một muối của axit hữu cơ. Có bao nhiêu công thức cấu tạo phù hợp với X?
Câu 26: Hòa tan hoàn toàn m gam Al2O3 cần tối thiểu 100 ml dung dịch NaOH 2M. Giá trị của m là
Câu 27: Cho các chất: NaOH, Cu, Fe, AgNO3, K2SO4. Số chất phản ứng được với dung dịch FeCl3 là
Câu 28: Hòa tan hoàn toàn 11,0 gam hỗn hợp X gồm Zn và Cu bằng dung dịch H2SO4 loãng dư, thu được 0,12 mol khí H2. Số mol Cu trong 11,0 gam X là
Câu 29: Hiđro hóa hoàn toàn triolein thu được triglixerit X. Đun X với dung dịch NaOH dư, thu được muối nào sau đây?
Câu 30: X và Y là hai cacbohiđrat. X là chất rắn, tinh thể không màu, dễ tan trong nước, có vị ngọt nhưng không ngọt bằng đường mía. Y là chất rắn dạng sợi, màu trắng, không có mùi vị. Tên gọi của X, Y lần lượt là
Câu 31: Lên men rượu m gam tinh bột thu được V lít CO2 (đktc). Toàn bộ lượng CO2 sinh ra được hấp thụ vào dung dịch Ca(OH)2 dư thu được 12 gam kết tủa. Biết hiệu suất quá trình lên men là 90%. Giá trị của m là
Câu 32: Cho 8,24 gam α-amino axit X (phân tử có một nhóm -COOH và một nhóm -NH2) phản ứng với dung dịch HCl dư thì thu được 11,16 gam muối. X là
Câu 33: Nhận xét nào sau đây đúng?
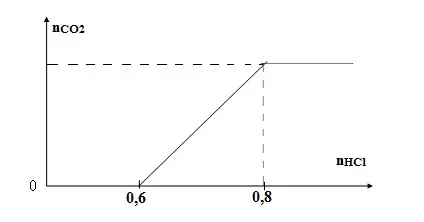
Câu 34: Khi nhỏ từ từ đến dư dung dịch HCl vào dung dịch hỗn hợp gồm a mol NaOH và b mol K2CO3 kết quả thí nghiệm được biểu diễn qua đồ thị sau: Tỉ lệ a:b là
Câu 35: Cho các phát biểu sau: (a) Các oxit của kim loại kiềm thổ đều tan tốt trong nước. (b) Thạch cao nung được sử dụng để bó bột trong y học. (c) Cho bột Al dư vào dung dịch FeCl3, phản ứng hoàn toàn thu được dung dịch chứa AlCl3 và FeCl2. (d) Sục khí CO2 đến dư vào dung dịch NaAlO2 thu được kết tủa. (e) Các kim loại kiềm khử nước dễ dàng ở nhiệt độ thường và giải phóng khí hiđro. Số phát biểu đúng là
Câu 36: Hỗn hợp X chứa butan, đietylamin, etyl propionat và valin. Đốt cháy hoàn toàn 0,4 mol X cần dùng 2,66 mol O2, thu được CO2, H2O và N2. Toàn bộ sản phẩm cháy được dẫn vào dung dịch Ca(OH)2 dư thì thấy có a mol khí không bị hấp thụ. Giá trị của a là
Câu 37: Cho các phát biểu sau: (a) Có thể dùng giấm ăn để giảm mùi tanh của cá. (b) Thủy phân hoàn toàn các triglixerit đều thu được glixerol. (c) Cao su lưu hóa có tính đàn hồi tốt hơn cao su chưa lưu hóa. (d) Khi nấu canh cua, riêu cua nổi lên trên là hiện tượng đông tụ protein. (e) Vải làm từ tơ nilon-6,6 kém bền trong nước xà phòng có tính kiềm. (g) Muối mononatri glutamat được sử dụng làm mì chính (bột ngọt). Số nhận xét đúng là
Câu 38: Hỗn hợp X gồm Na, Ba, Na2O, BaO. Hòa tan hết 107,9 gam hỗn hợp X vào nước thu được 7,84 lít H2 (đktc) và dung dịch kiềm Y trong đó có 28 gam NaOH. Hấp thụ 17,92 lít khí SO2 (đktc) vào dung dịch Y thu được m gam kết tủa. Giá trị của m là
Câu 39: Cho hỗn hợp X gồm 2 chất A (C5H16N2O3) và B (C2H8N2O3) có tỉ lệ số mol là 3 : 2 tác dụng với lượng dư dung dịch NaOH đun nóng. Sau phản ứng thu được dung dịch chứa 4,88 gam hỗn hợp 2 muối và 1 khí duy nhất làm xanh giấy quỳ ẩm. Phần trăm khối lượng của A trong X có giá trị gần nhất với giá trị nào sau đây:
Câu 40: Cho 8,64 gam Mg vào dung dịch hỗn hợp NaNO3 và H2SO4, đun nhẹ hỗn hợp phản ứng, lúc đầu tạo ra sản phẩm khử là khí NO, sau đó thấy thoát ra khí không màu X. Sau khi các phản ứng kết thúc thấy còn lại 4,08 gam chất rắn không tan. Biết rằng tổng thể tích của hai khí NO và X là 1,792 lít (đktc) và tổng khối lượng là 1,84 gam. Cô cạn cẩn thận dung dịch sau phản ứng thu được m gam chất muối khan. Giá trị nào sau đây gần với m nhất?